Class 9 Science Chapter 4 পরমাণুর গঠন Notes to each chapter is provided in the list so that you can easily browse throughout different chapter Class 9 Science Chapter 4 পরমাণুর গঠন and select needs one.
Class 9 Science Chapter 4 পরমাণুর গঠন
Also, you can read SCERT book online in these sections Class 9 Science Chapter 4 পরমাণুর গঠন Solutions by Expert Teachers as per SCERT (CBSE) Book guidelines. Class 9 Science Chapter 4 পরমাণুর গঠন These solutions are part of SCERT All Subject Solutions. Here we have given Class 9 Science in Bengali Chapter 4 পরমাণুর গঠন for All Subject, You can practice these here…
পরমাণুর গঠন
Chapter – 4
পাঠ্যপুস্তকের প্রশ্নোত্তরঃ
প্রশ্ন ১। কেনেল রশ্মি (Canal rays) কাকে বলে ?
উত্তরঃ বিদ্যুৎ মোক্ষম নলীতে ছোট ছোট ছিদ্রযুক্ত ক্যাথোড ব্যবহার করা হলে ক্যাথোড রশ্মির বিপরীত দিকে অন্য একটি রশ্মিকে গতি করতে দেখা যায়। এই রশ্মি নলীর ভিতরের গ্যাসের ধনাত্মক আধান যুক্ত অণু বা পরমাণুর দ্বারা গঠিত। এই রশ্মিকে সুড়ঙ্গ রশ্মি (Canal rays) অ্যানোড রশ্মি বা ধনাত্মক রশ্মি (Anode rays) বা ধনাত্মক রশ্মি (Positive rays) বলা হয়। 1914 সালে রাদারফোর্ড মোক্ষম নলীতে হাইড্রোজেন গ্যাস ব্যবহার করে পান যে উৎপন্ন হওয়া অ্যানোড রশ্মির কণিকাগুলির ভর হাইড্রোজেন পরমাণুর ভরের সমান এবং এইগুলি ইলেক্ট্রনের সমপরিমাণ কিন্তু ধনাত্মক আধানযুক্ত হাইড্রোজেন আয়ন (H⁺)। এই কণিকাগুলিই প্রোটন।
সুড়ঙ্গ রশ্মিকণার ভর ইলেক্ট্রনের ভর হতে 2000 গুণ বেশী।
প্রশ্ন ২। যদি কোন পরমাণুতে একটি ইলেক্ট্রন এবং একটি প্রোটন থাকে তাহলে পরমাণুটির আধান থাকবে কিনা উত্তর দাও।
উত্তরঃ একটি ইলেক্ট্রন এবং একটি প্রোটন থাকা পরমাণু কোন আধান বহন করবে না। অর্থাৎ এরা নিরপেক্ষ পরমাণু হবে।
প্রশ্ন ৩। পরমাণুর নিউক্লিয়াসে কোন পারমাণবিক কণা আছে রাদারফোর্ডের পরমাণু মডেলের ভিত্তিতে উত্তর দাও।
উত্তরঃ রাদারফোর্ডের পরমাণু নমুনার মতে নিউক্লীয়াসে প্রোটন থাকে।
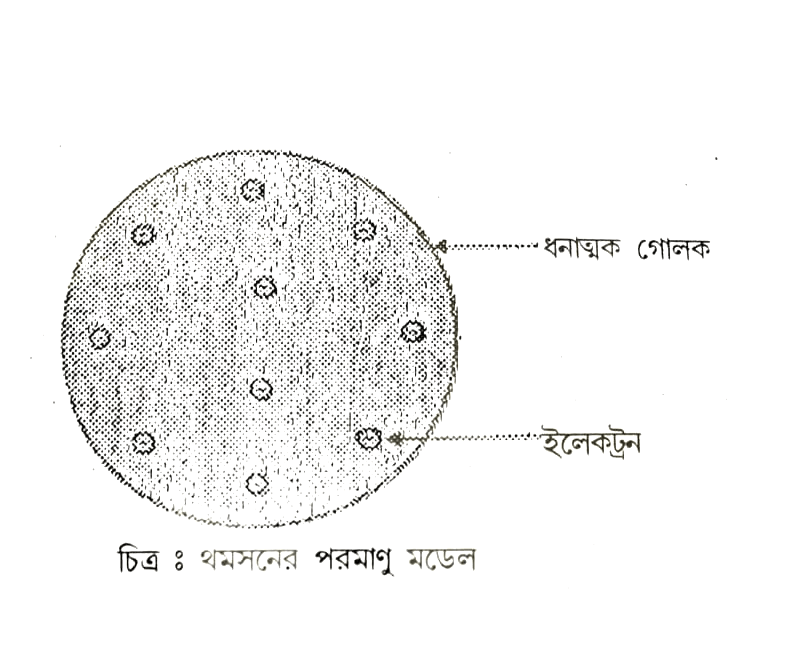
প্রশ্ন ৪। পরমাণু সামগ্রিকভাবে কিভাবে তড়িৎ নিরপেক্ষ তা থমসনের পরমাণু মডেলের ভিত্তিতে ব্যাখ্যা কর।
উত্তরঃ কোন পরমাণুতে ঋণাত্মক এবং ধনাত্মক আধানের সংখ্যা এবং মান সমান হওয়ার জন্য পরমাণুটি সম্পূর্ণ বৈদ্যুতিক উদাসীন হয়।
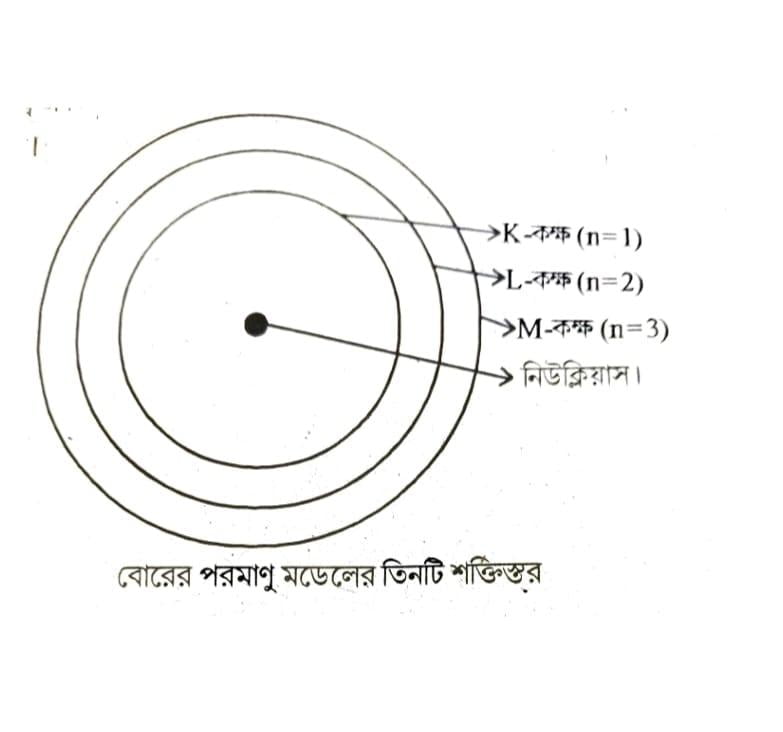
প্রশ্ন ৫। বোরের মডেল অনুযায়ী তিনটি কক্ষপথ থাকা একটি পরমাণুর রেখাচিত্র অংকন কর।
উত্তরঃ
প্রশ্ন ৬। a কণার বিচ্ছুরণ পরীক্ষাটি যদি সোনা ছাড়া অন্য ধাতুর পাড় ব্যবহার করা হয় তাহলে পর্যবেক্ষণটি কি হবে বলে মনে হয় ?
উত্তরঃ রাদারফোর্ডের পরীক্ষায় একটি অতি পাতলা সোনার পাতকে (0.00004 সে.মি. উচ্চতা) কণিকার দ্বারা আঘাত করা হয়। এই কণিকা হল কিছু তেজক্রিয় মৌলের (যেমন রেডিয়াম) থেকে নির্গত দুই একক ধনাত্মক আধান বিশিষ্ট হিলিয়াম পরমাণু একটি লেডের (সীসা Pb) ছিদ্রযুক্ত পাতের মধ্য দিয়ে চালিত করলে a কণিকার একটি সুষম রশ্মি পাওয়া যায়। এই রশ্মি সোনার পাতে আঘাত করলে চারিদিকে বিচ্ছুরিত হয়। এখন সোনার বদলে অন্য কোন ধাতুর পাতে কোন পরিবর্তন দেখা যাবে না।
প্রশ্ন ৭। একটি পরমাণুর তিনটি অবপারমাণবিক কণার নাম লিখ।
উত্তরঃ (i) ইলেক্ট্রন (₀e⁻¹)
(ii) প্রোটন (₁p⁺¹)
(iii) নিউট্রন (₁n⁰)
প্রশ্ন ৮। হিলিয়াম পরমাণুর পারমাণবিক ভর হচ্ছে 4u এবং এটার নিউক্লিয়াসে আছে দুটো প্রোটন। এটাতে কতগুলো নিউট্রন আছে ?
উত্তরঃ কোন পরমাণুর ভর বলতে আমরা বুঝি যে, পরমাণুটির নিউক্লীয়াসে থাকা প্রোটন এবং নিউট্রনের ভরের সমষ্টি। এখন হিলিয়াম পরমাণুর পারমাণবিক ভর 4u এবং এতে 2টি প্রোটন আছে।
সুতরাং ইহাতে 2টি নিউট্রন থাকবে।
প্রশ্ন ৯। কার্বন ও সোডিয়াম পরমাণুর ইলেক্ট্রনীয় বিন্যাস লিখে দেখাও।
উত্তরঃ কার্বনের 6 টি ইলেক্ট্রন আছে। সুতরাং এর ইলেক্ট্রনিয় বিন্যাস হবে 2,4 অর্থাৎ k কক্ষে 2 টি এবং L কক্ষে 4 টি ইলেক্ট্রন থাকে। সোডিয়ামে 11টি ইলেক্ট্রন থাকে। সুতরাং এর ইলেক্ট্রনিয় বিন্যাস হবে, 2,8,1. অর্থাৎk কক্ষে 2 টি, L কক্ষে ৪ টি এবং m কক্ষে 1 টি ইলেক্ট্রন থাকে।
প্রশ্ন ১০। যদি কোন পরমাণুর K এবং L কক্ষ পূর্ণ থাকে তবে এই পরমাণুতে থাকা ইলেক্ট্রনের মোট সংখ্যা কত ?
উত্তরঃ K কক্ষে সবচেয়ে বেশী 2টি এবং L কক্ষে সবচেয়ে বেশী ৪টি ইলেক্ট্রন থাকতে পারে।
সুতরাং 2 + 8 = 10 টি ইলেক্ট্রন থাকবে যদি K এবং L কক্ষপূর্ণ থাকে।
প্রশ্ন ১১। ক্লোরিন সালফার এবং মেগনেসিয়ামের যোজ্যতা কিভাবে বের করবে ?
উত্তরঃ ইলেক্ট্রনীয় বিন্যাস-
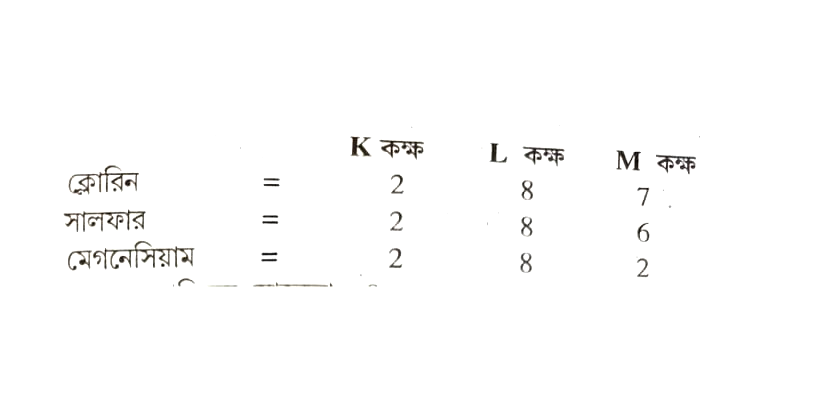
সুতরাং, ক্লোরিনের যোজ্যতা = 8 – 7 = 1
সালফারের যোজ্যতা = 8 – 6 = 2
মেগনেসিয়ামের যোজ্যতা = 2
প্রশ্ন ১২। যদি কোন পরমাণুতে ইলেক্ট্রনের সংজ্ঞা 8 এবং প্রোটনের সংজ্ঞাও 8 হয় তাহলে-
(i) পরমাণুটির পারমাণবিক সংজ্ঞা । এবং
(ii) পরমাণুটির আধান কত ?
উত্তরঃ (i) পারমাণবিক সংজ্ঞা = প্রোটনের সংখ্যা = ৪
(ii) পরমাণুটির উপর আধানের পরিমাণ = 0
প্রশ্ন ১৩। 4.1 তালিকার সাহায্যে অক্সিজেন এবং সালফার পরমাণুর ভরসংখ্যা নির্ণয় কর।
উত্তরঃ অক্সিজেন পরমাণুতে প্রোটনের সংখ্যা = 8
অক্সিজেন পরমাণুতে নিউট্রনের সংখ্যা = 8
∴ অক্সিজেনের পারমাণবিক ভর = 8 + 8 = 16 গ্রাম।
সালফার পরমাণুতে প্রোটনের সংখ্যা = 16
সালফার পরমাণুতে নিউট্রনের সংখ্যা = 16
∴ সালফারের পারমাণবিক ভর = 16 + 16 = 32 গ্রাম।
প্রশ্ন ১৪। H, D এবং T-এই তিনটি চিহ্নের প্রত্যেকটির তিনটি করে অবপারমাণবিক কণা তালিকাবদ্ধ কর।
উত্তরঃ হাইড্রোজেন (H) ডিউটেরিয়াম (D) ট্রিসিয়াম (T)
ইলেক্ট্রন – 1, 1, 1
প্রোটন – 1, 1, 1
নিউট্রন – 0, 1, 2
প্রশ্ন ১৭। যে কোন এক জোড়া সমস্থানিক ((Isotope) এবং সমভারীর (Isobar) ইলেক্ট্রনীয় বিন্যাস লিখ।
উত্তরঃ ¹²₆C এবং ¹⁴₆C হল সমস্থানিক। এদের ইলেক্ট্রনীয় বিন্যাস একই 2,6 ²²₁₀Ne এবং ²²₁₁Na হল সমভারী (Isobar), এদের ইলেক্ট্রনীয় বিন্যাস বিভিন্ন – নীচে দেওয়া হল – ²²₁₀Ne = 2, 8 এবং ²²₁₁Na 2, 8, 1.
অনুশীলনীর প্রশ্নোত্তরঃ
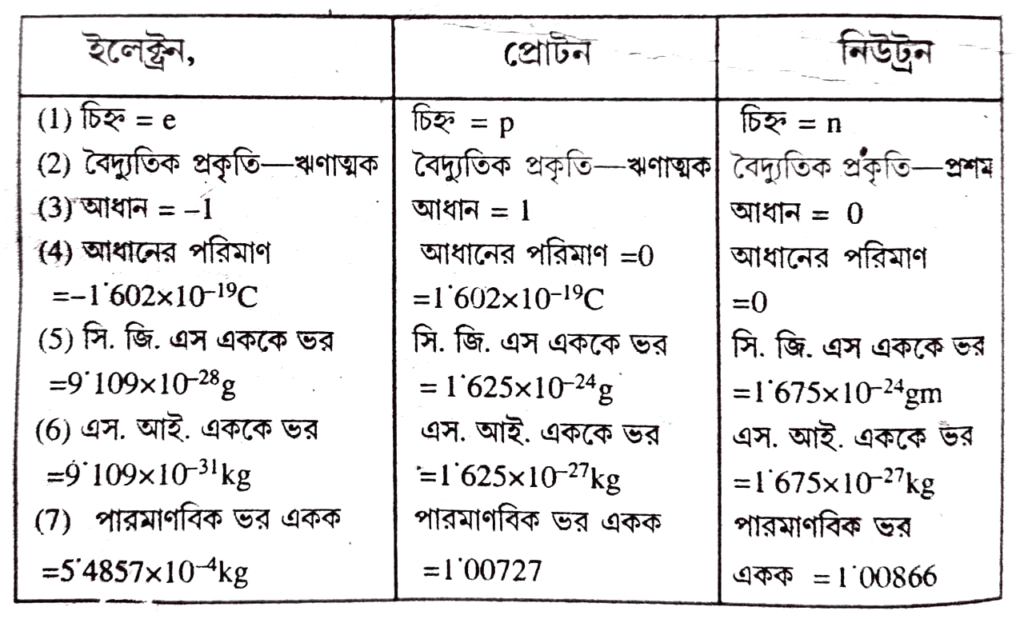
প্রশ্ন ১। ইলেক্ট্রন, প্রোটন এবং নিউট্রনের ধর্মগুলো তুলনা কর।
উত্তরঃ
প্রশ্ন ২। জে. জে. থমসনের পরমাণু মডেলের সীমাবদ্ধতা গুলো কি কি ?
উত্তরঃ জে. জে. থমসনের মতে কোন পরমাণুর ভর উহার ইলেক্ট্রন এবং প্রোটনের উপর নির্ভরশীল, যারা সমস্ত পরমাণুর মধ্যে ছড়িয়ো থাকে।
কিন্তু রাদারফোর্ড এই সিদ্ধান্ত পুরোপুরি মেনে নিতে পারেননি এবং ব্যাখ্যা করেন যে পরমাণুর ভর খুব অল্প জায়গার মধ্যে সীমাবদ্ধ থাকে যাকে নিউক্লিয়াস। বলে।
প্রশ্ন ৩। রাদারফোর্ডের পরমাণু মডেলের সীমাবদ্ধতাগুলো কি কি ?
উত্তরঃ রাদারফোর্ডের পরমাণু মডেলটি সুস্থির নয় বলে বিজ্ঞানী নীল বোর প্রথম প্রমাণ করেছিলেন। শক্তি বিকিরণের বিদ্যুৎ চুম্বকীয় সূত্র অনুসারে কোন আধানযুক্ত বস্তু বৃত্তাকার পথে ঘোরার সময় নিরবিচ্ছিন্নভাবে শক্তি বিকিরণ করে। সুতরাং রাদারফোর্ডের বর্ণনা অনুযায়ী বৃত্তাকারে ঘোরার সময় ইলেক্ট্রনগুলিও শক্তি বিক্রিরণ করে। এর ফলস্বরূপ ইলেক্ট্রনের শক্তি ক্রমান্বয়ে হ্রাস পাবে এবং ইলেক্ট্রনগুলি কুণ্ডলীর মত পথে ঘুরে অবশেষে নিউক্লিয়াসে প্রবেশ করবে। অর্থাৎ সৌরজগতের মত রাদারফোর্ডের পরমাণু সুস্থির নয়।
প্রশ্ন ৪। বোরের পরমাণু মডেল বর্ণনা কর।
উত্তরঃ বোরের নতুন মডেলের প্রস্তাব অনুযায়ী-
(i) পরমাণুর কেন্দ্রে ছোট নিউক্লিয়াস থাকে।
(ii) পরমাণুটির ভর নিউক্লিয়াসে কেন্দ্রীভূত থাকে। নিউক্লিয়াসের আয়তন পরমাণুটি হতে ছোট হয় এবং যার অনুপাত 1:105.
(iii) পরমাণুর ইলেক্ট্রনগুলি নিউক্লিয়াসের চারিদিকে নির্দিষ্ট বৃত্তাকার কক্ষপথে ভ্রমণ করে। এই কক্ষপথকে স্থির কক্ষপথ বা শক্তিস্তর বলা হয়।
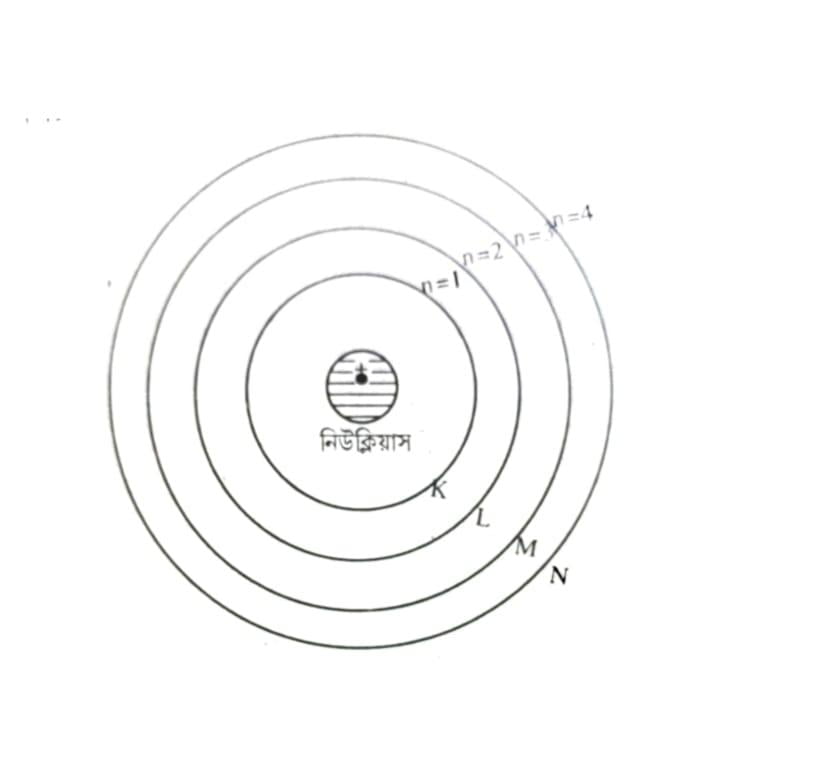
(iv) প্রতিটি শক্তিস্তরে নির্দিষ্ট পরিমাণ শক্তি নিহিত থাকে। শক্তিস্তরগুলিকে K, L, M, N… বা 1, 2, 3, 4. সংখ্যা দিয়ে বোঝানো হয়। নিউক্লিয়াসের সবচেয়ে কাছের শক্তিস্তরটির (K শক্তিস্তর বা 1 শক্তিস্তর) শক্তি নিম্নতম। কক্ষপথগুলির শক্তি নিউক্লিয়াসের সঙ্গে দূরত্ব বৃদ্ধির সঙ্গে সঙ্গে বেড়ে যায়। অর্থাৎ শক্তিস্তরের শক্তি বৃদ্ধির ক্রম হল K < L < M < N…..(বা 1< 2< 3< 4)।
(v) নির্দিষ্ট কক্ষপথে ঘোরার সময় একটি ইলেক্ট্রনে নির্দিষ্ট পরিমাণ শক্তি নিহিত থাকে। অর্থাৎ স্থির কক্ষপথে থাকা ইলেক্ট্রন শক্তি বিকিরণ করে না।
(vi) নির্দিষ্ট পরিমাণ শক্তি শোষণ বা বিকিরণ করে ইলেক্ট্রন একটি কক্ষপথ থেকে অন্য কক্ষপথে বিচরণ করতে পারে। কম শক্তির কক্ষপথ থেকে উচ্চশক্তির কক্ষপথে যাওয়ার সময় ইলেক্ট্রনটি শক্তি শোষণ করে এবং উচ্চশক্তির কক্ষপথ থেকে কম শক্তির কক্ষপথে প্রব্রজন করার সময় ইলেক্ট্রনটি শক্তি নির্গত করে।
প্রশ্ন ৫। এই অধ্যায়ে বর্ণিত পরমাণুর প্রস্তাবিত সবগুলো মডেল তুলনা কর।
উত্তরঃ
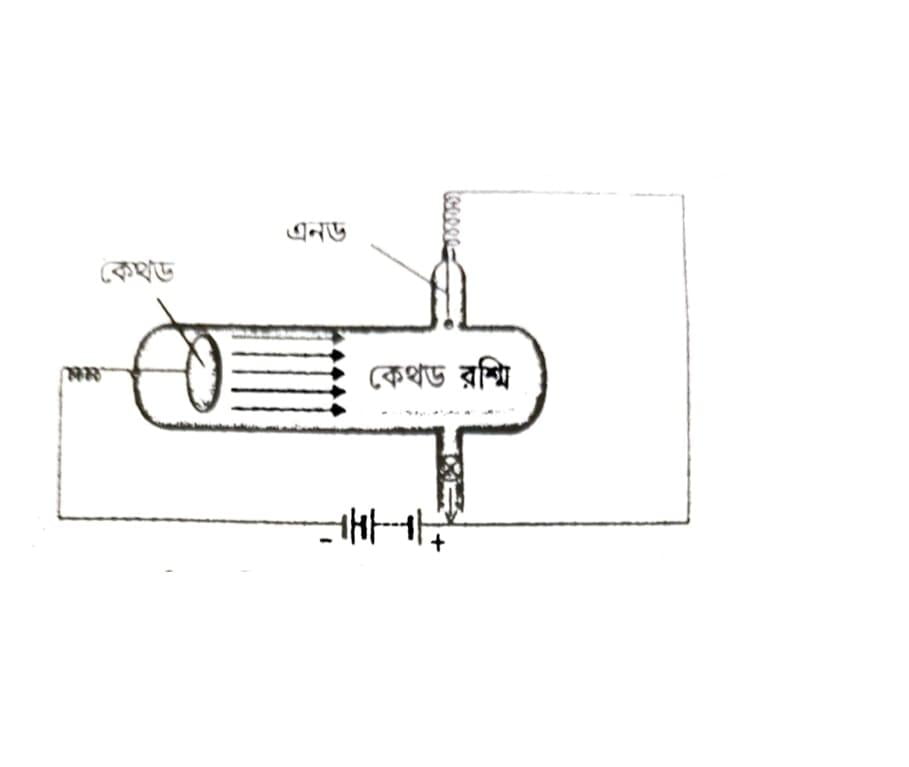
জে. জে. থমসন (J. J. Thomson) – বিদ্যুৎ মোক্ষম নলীতে খুব কম চাপে ( প্রায় 0.03 মি. মি. পারদস্তম্ভের চাপ) বিদ্যুৎ প্রবাহিত হলে ক্যাথোডের থেকে অ্যানোডের দিকে নীলচে সবুজ রং-এর একটি রশ্মিকে সরলরেখায় গতি করতে দেখা যায়। এই রশ্মিকে ক্যাথোড (Cathode) রশ্মি বলে। ক্যাথোড রশ্মির উপরে করা বিভিন্ন পরীক্ষায় প্রমাণিত হয় যে, এই রশ্মি ঋণাত্মক আধানযুক্ত ও অতি নগণ্য ভরবিশিষ্ট কয়েকটি কণিকার দ্বারা গঠিত। এই কণিকাগুলিকে জে. জে. থমসন (1897) ইলেক্ট্রন হিসাবে সনাক্ত করেন।
রাদারফোর্ড (E. Rutherford) –
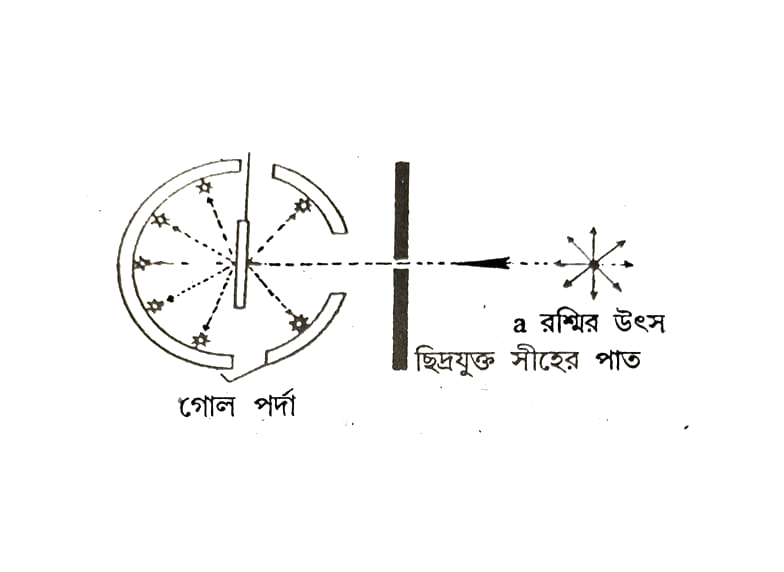
ইঃ রাদারফোর্ড 1911 সালে পরমাণুর গঠনের বিষয়ে একটি মতবাদ প্রবর্তন করেন। এই মতবাদ অনুযায়ী তিনি পরীক্ষায় একটি অতি পাতলা সোনার পাতকে (0.00004 সে.মি উচ্চতা) a কণিকার দ্বারা আঘাত করেছিলেন। এই a কণিকা হল কিছু তেজষ্ক্রিয় মেটালের (যেমন রেডিয়াম) থেকে নির্গত দুই একক ধনাত্মক আধান বিশিষ্ট হিসিয়াম পরমাণু একটি লেডের (সীসা Pb) ছিদ্রযুক্ত পাতের মধ্য দিয়ে চালিত করলে a কণিকার একটি সুষম রশ্মি পাওয়া যায়। এই রশ্মি সোনার পাতে আঘাত করলে চারিদিকে বিচ্ছুরিত হয়। সোনার পাতটির চারিদিকে জিংক সালফাইডের প্রলেপ থাকা পর্দা দেওয়া থাকে। বিচ্ছুরিত a কণিকা পর্দায় আঘাত করলে প্রতি-প্রভাব সৃষ্টি হয় যার থেকে a রশ্মির বিচ্যুতির পরিমাণ নির্ণয় করা যায়।
নীল বোর (Neil Bohr) –
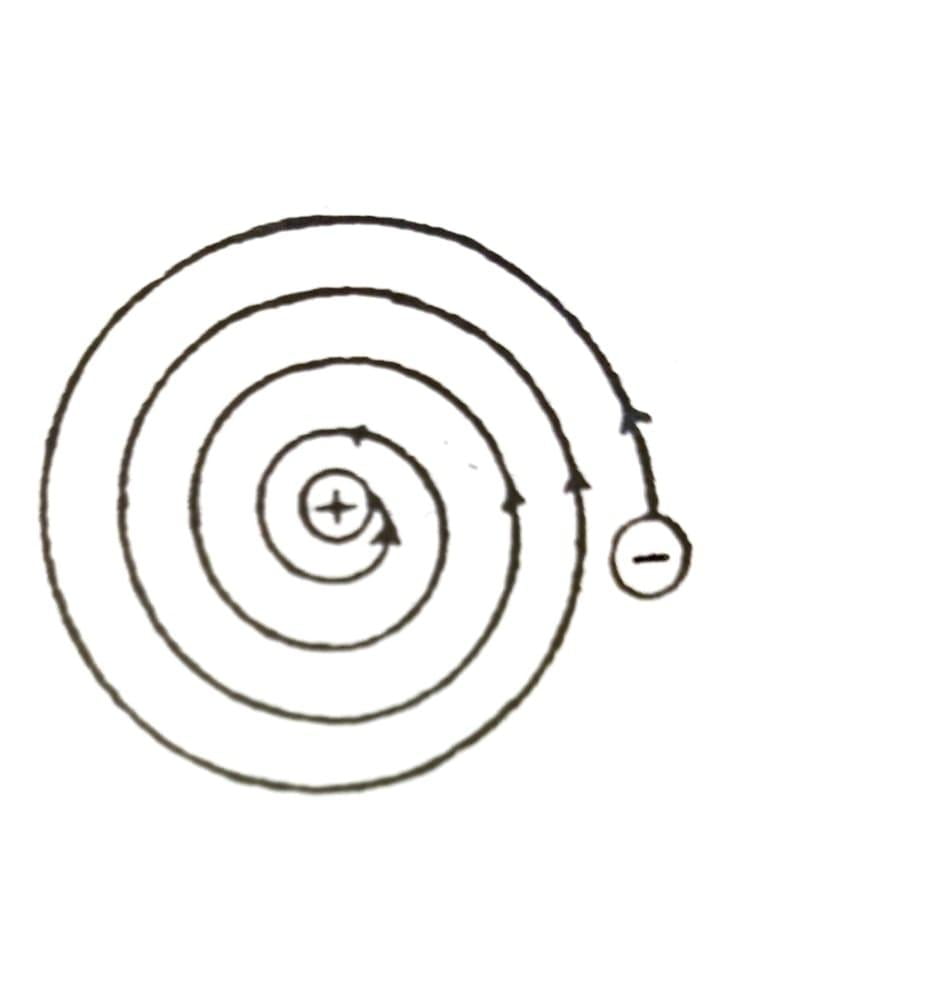
শক্তির বিকিরণের বিদ্যুৎ চুম্বকীয় সূত্র অনুসারে কোন আধানযুক্ত বস্তু বৃত্তাকার পথে ঘোরার সময় নিরবচ্ছিন্নভাবে শক্তি বিকিরণ করে। সুতরাং রাদারফোর্ডের বর্ণনা অনুযায়ী বৃত্তাকারে ঘোরার সময় ইলেক্ট্রনগুলিও শক্তি বিকিরণ করবে। অর্থাৎ সৌরজগতের মত রাদারফোর্ডের পরমাণু সুস্থির নহে। পরমাণুর ইলেক্ট্রনগুলি নিউক্লিয়াসের চারদিকে নির্দিষ্ট বৃত্তাকার কক্ষপথে ভ্রমণ করে। সেই কক্ষপথ-গুলিকে শক্তিস্তর বলে। শক্তিস্তরগুলি K, L, M, N… দ্বারা বোঝানো হয়। শক্তিস্তরের বৃদ্ধির ক্রম হল K< L< M< N।
প্রশ্ন ৬। প্রথম আঠারোটি মৌলের পরমাণুর বিভিন্ন কক্ষপথে ইলেক্ট্রনীয় বিন্যাস লিখার নিয়মগুলো সংক্ষেপে উপস্থাপিত কর।
উত্তরঃ বিভিন্ন শক্তিস্তরে ইলেক্ট্রনের সজ্জা বা বিন্যাস সম্পর্কে বোর-বেরী প্রকল্পের নিয়মগুলি নীচে দেওয়া হল-
(i) পরমাণুর যে কোন কক্ষে সর্বাধিক 2n² সংখ্যক ইলেক্ট্রন থাকতে পারে। এখানে n হল শক্তিস্তরটির ক্রমিক সংখ্যা অর্থাৎ প্রথম শক্তিস্তরে ইলেক্ট্রনের সর্বাধিক সংখ্যা (n = 1,k কক্ষ) = 2×1¹² = 2.
দ্বিতীয় শক্তিস্তরে ইলেক্ট্রনের সর্বাধিক সংখ্যা (n = 2, L কক্ষ) = 2×2² = 8
তৃতীয় শক্তিস্তরে ইলেক্ট্রনের সর্বাধিক সংখ্যা (n = 3, M কক্ষ) = 2×2³ = 18
(ii) পরমাণুর একদম বাহিরের কক্ষে ৪টি এবং তার আগের কক্ষটিতে ৪টির বেশী ইলেক্ট্রন থাকতে পারে না।
(iii) একটি কক্ষ পূর্ণ হওয়ার আগেও একটি নতুন কক্ষতে ইলেক্ট্রন প্রবেশ করতে পারে।
প্রশ্ন ৭। সিলিকন এবং অক্সিজেনের উদাহরণ নিয়ে যোজ্যতার সংজ্ঞা লিখ।
উত্তরঃ রাসায়নিক বিক্রিয়ায় কোন মৌলের একটি পরমাণু নিকটতম সম্ভ্রান্ত গ্যাসের ইলেক্ট্রনীয় সংজ্ঞা লাভ করার জন্য যে সংখ্যক ইলেক্ট্রন ত্যাগ, গ্রহণ বা বণ্টন করে সেই সংখ্যাটিকেই মৌলটির যোজ্যতা বলা হয়। অর্থাৎ পরমাণুর বহিঃকক্ষে থাকা ইলেক্ট্রনের সংজ্ঞাই হল যোজ্যতা। কিন্তু যদি বহিঃকক্ষে পূর্ণ সংখ্যক ইলেক্ট্রন থাকে তবে (8 – যোজক ইলেক্ট্রনই হবে যোজ্যতা। সিলিকনের যোজক ইলেক্ট্রন 4, সেইজন্য এর যোজ্যতা = 4
অক্সিজেনের যোজক ইলেক্ট্রন 6, সেজন্য যোজ্যতা = (8–6) = 2
প্রশ্ন ৮। উদাহরণসহ ব্যাখ্যা কর।
(i) পারমাণবিক সংখ্যা।
(ii) ভর সংখ্যা।
(iii) সমস্থানিক। এবং
(iv) সমভারী, সমস্থানিকের যে কোন দুটো ব্যবহার লিখ।
উত্তরঃ (i) পারমাণবিক সংখ্যা (Atomic Number) – মৌলের পরমাণুতে একটি নির্দিষ্ট সংখ্যক প্রোটন থাকে। মৌলের পরমাণু এই ধনাত্মক আধানের সংখ্যা পর্যাবৃত্ত তালিকায় মৌলটির ক্রমসূচক সংখ্যার সমান। এই সংখ্যাটিকে মৌলটির পারমাণবিক সংখ্যা বা পরমাণু ক্রমাংক বলা হয়। অর্থাৎ কোন মৌলের পরমাণুতে থাকা প্রোটনের সংখ্যাই হল মৌলটির পারমাণবিক সংখ্যা। যেমন- কার্বনে 6 টি প্রোটন থাকে। সুতরাং কার্বনের পারমাণবিক সংখ্যা 6।
(ii) ভর সংখ্যা (Mass Number) – পরমাণুর প্রোটন এবং নিউট্রনকে একত্রে নিউক্লিয়ন বলা হয়। এই নিউক্লিয়নগুলি পরমাণুকেন্দ্রে বা নিউক্লিয়াসে থাকে। পরমাণুর নিউক্লিয়াসে থাকা নিউক্লিয়নের মোট সংখ্যাকে পরমাণুটির ভরসংখ্যা বা ভর ক্রমাংক বলা হয়। যদি পরমাণুটির P সংখ্যক প্রোটন এবং n সংখ্যক নিউট্রন থাকে তবে পরমাণুটির ভর A = p+n।
যেমন- কার্বনের নিউক্লিয়াসে 6 টি প্রোটন এবং 6 টি নিউট্রন থাকে। সুতরাং কার্বনের ভর সংখ্যা 6+6=12।
(iii) সমস্থানিক (Isotoper) – এক পারমাণবিক সংখ্যাযুক্ত বিভিন্ন ভর সংখ্যার মৌলকে সমস্থানিক বলা হয়। যেমন- হাইড্রোজেনের তিনটি বিভিন্ন ভর বিশিষ্ট নিউক্লাইড আছে। এই নিউক্লাইডগুলির চিহ্ন ¹₂H, ²₁H, ³₁H। এই নিউক্লিয়ডগুলি যথাক্রমে হাইড্রোজেন, ডয়টেরিয়াম ও ট্রিসিয়াম নামে পরিচিত। এইগুলি হাইড্রোজেনের সমস্থানিক।
(iv) সমভারী (Isobars) – কখনও কখনও দুই বা ততোধিক মৌলের ভরসংখ্যা একই হইতে পারে। বিভিন্ন মৌলের সমান ভরসংখ্যা বিশিষ্ট নিউক্লাইডকে সমভারী বলে। যেমন- প্রকৃতিতে পটাসিয়াম, আর্গন ও কেলসিয়ামের 40 ভরসংখ্যা বিশিষ্ট তিন ধরনের নিউক্লাইড পাওয়া যায়। এগুলি হইল, ⁴⁰₁₈Ar, ⁴⁰₁₉K, ⁴⁰₂₀Ca এই নিউক্লাইডগুলি সমভারী।
সমস্থানিকের ব্যবহার –
(i) কোবাল্টের সমস্থানিক ⁶⁰Co ক্যান্সার রোগের চিকিৎসায় ব্যবহৃত হয়।
(ii) ইউরেনিয়ামের সমস্থানিক (²³⁵U) নিউক্লিও রিয়েক্টরে ইন্ধন হিসাবে ব্যবহৃত হয়।
প্রশ্ন ৯। Na⁺ -এ K এবং L কক্ষ দুটো সম্পূর্ণরূপে পূর্ণ। ব্যাখ্যা কর।
উত্তরঃ সোডিয়ামের পারমাণবিক সংখ্যা 11. সুতরাং উদাসীন সোডিয়াম পরমাণুতে 11টি ইলেক্ট্রন থাকে। Na⁺ -এ 10টি ইলেক্ট্রন থাকে, এই 10টির মধ্যে K কক্ষে 2টি এবং L কক্ষে ৪টি ইলেক্ট্রন থাকে। সুতরাং Na⁺ সম্পূর্ণভাবে K কক্ষ এবং L কক্ষ পূর্ণ করে।
প্রশ্ন ১০। যদি ক্রোমিন দুটো সমস্থানিকরূপে থাকে ⁷⁹₃₅Br (49.7%) এবং ⁸¹₃₅Br (50.3%) তাহলে ক্রোমিন পরমাণুর গড় পারমাণবিক ভর নির্ণয় কর।
উত্তরঃ 79u পারমাণবিক ভর থাকা ক্রোমিনে সমস্থানিক = 49.7%
∴ ⁷⁹₃₅Br এর পারমাণবিক ভর = 79 x 49.7/100 = 39.26u
আবার 81u পারমাণবিক ভর থাকা ক্রোমিনের সমস্থানিক = 50.3%
∴ ⁸¹₃₅Br এর পারমাণবিক ভর = 81 x 50.3/100
=40.74u
∴ ক্রোমিনের গড় পারমাণবিক ভর = 39.26 + 40.74/80u
প্রশ্ন ১১। X মৌলের গড় পারমাণবিক ভর হচ্ছে 16.2u। ∴ ¹⁶₈X এবং ¹⁸₈X এই দুটো সমস্থানিকের শতাংশ নির্ণয় কর ?
উত্তরঃ মনে করি ¹⁶₈X এর শতাংশ হার = A
∴ ¹⁸₈X এর শতাংশ হার = 100 – A
সুতরাং, 16 x A/100 + (100-A) x 18/100 = 16.2
= 16A + 1800 – 18A/100 = 162/10
= 1800 – 2A = 1620
= 2A = 1620 – 1800
2A = 180
= A = 180/2
∴ A = 90
∴ ¹⁶₈X হল 90% এবং ¹⁸₈X হল (100–90) = 10%
প্রশ্ন ১২। যদি Z = 3 হয়, তাহলে মৌলটির যোজ্যতা কত ? মৌলটির নামও উল্লেখ কর।
উত্তরঃ Z = 3. সুতরাং পারমাণবিক সংখ্যা 3
∴ মৌলটি হল লিথিয়াম। ইলেক্ট্রনীয় বিন্যাস 2, 1
সুতরাং লিথিয়ামের যোজ্যতা = 1
প্রশ্ন ১৩। X এবং Y এই দুই প্রকারের পরমাণুর নিউক্লিয়াসের সংযুতি নীচে দেওয়া হল-
X – Y
প্রোটন = 6 – 6
নিউট্রন = 6 – 8
X এবং Y এর ভর সংখ্যা কত ? এই দুইপ্রকারের পরমাণুর সম্পর্ক কি?
উত্তরঃ X -এর ভর সংখ্যা = 6 + 6 = 12
Y -এর ভর সংখ্যা = 6 + 8 = 14
যেহেতু X এবং Y দুইটিরই পারমাণবিক সংখ্যা 6 কিন্তু ভর সংখ্যা বিভিন্ন সেইজন্য X এবং Y পরস্পরের সমস্থানিক।
প্রশ্ন ১৪। নিম্নোক্ত উক্তিগুলোর ক্ষেত্রে শুদ্ধ উত্তরের জন্য T এবং ভুল উত্তরের জন্য লিখ F
(a) co.co. সমমান প্রস্তাব করেছিলেন যে পরমাণুর নিউক্লিয়াসে কেবল নিউক্লিয়ন থাকে।
উত্তরঃ অশুদ্ধ।
(b) একটি প্রোটন এবং একটি ইলেক্ট্রন যুক্ত হয়ে একটি নিউট্রন তৈরী হয়। সেইজন্য এটা আধানহীন।
উত্তরঃ অশুদ্ধ।
(c) ইলেক্ট্রনীয় ভর প্রোটনের ভরের প্রায় 1/2000 গুণ।
উত্তরঃ শুদ্ধ।
(d) আয়োডিনের একটি সমস্থানিক টিংচার অব আয়োডিন তৈরী করতে ব্যবহার করা হয় যা একটি ঔষধ হিসাবে ব্যবহৃত হয়।
উত্তরঃ শুদ্ধ।
প্রশ্ন 15, 16, 17 নম্বর প্রশ্নগুলোতে শুদ্ধ বিকল্পের ক্ষেত্রে ঠিক (✔) চিহ্ন ও ভুল বিকল্পের ক্ষেত্রে ক্রস (x) চিহ্ন দাও।
প্রশ্ন ১৫। রাদারফোর্ডের – কণা বিচ্ছুরণ পরীক্ষার ফলেই আবিষ্কৃত হয়েছিল-
(a) পরমাণুর কেন্দ্র বা নিউক্লিয়াস।
উত্তরঃ ✔
(b) ইলেক্ট্রন।
উত্তরঃ x
(c) প্রোটন।
উত্তরঃ x
(d) নিউট্রন।
উত্তরঃ x
প্রশ্ন ১৬। কোন মৌলের সমস্থানিক গুণের –
(a) একই ভৌতিক ধর্ম থাকে।
উত্তরঃ (a) ×
(b) ভিন্ন ভিন্ন রাসায়নিক ধর্ম থাকে।
উত্তরঃ x
(c) নিউট্রনের সংখ্যান ভিন্ন।
উত্তরঃ ✔
(d) পারমাণবিক সংখ্যা ভিন্ন।
উত্তরঃ x
প্রশ্ন ১৭। CI আয়নে যোজক ইলেক্ট্রনের সংখ্যা হচ্ছে-
(a) 16
উত্তরঃ (a) ×
(b) 8
উত্তরঃ ✔
(c) 17
উত্তরঃ x
(d) 18
উত্তরঃ x
প্রশ্ন ১৮। নিম্নোক্তগুলোর মধ্যে কোনটি সোডিয়ামের সঠিক ইলেক্ট্রনীয় বিন্যাস।
(a) 2,8
(b) 8, 2,1
(c) 2,1,8
(d) 2,8,1.
উত্তরঃ (d) 2, 8, 1.
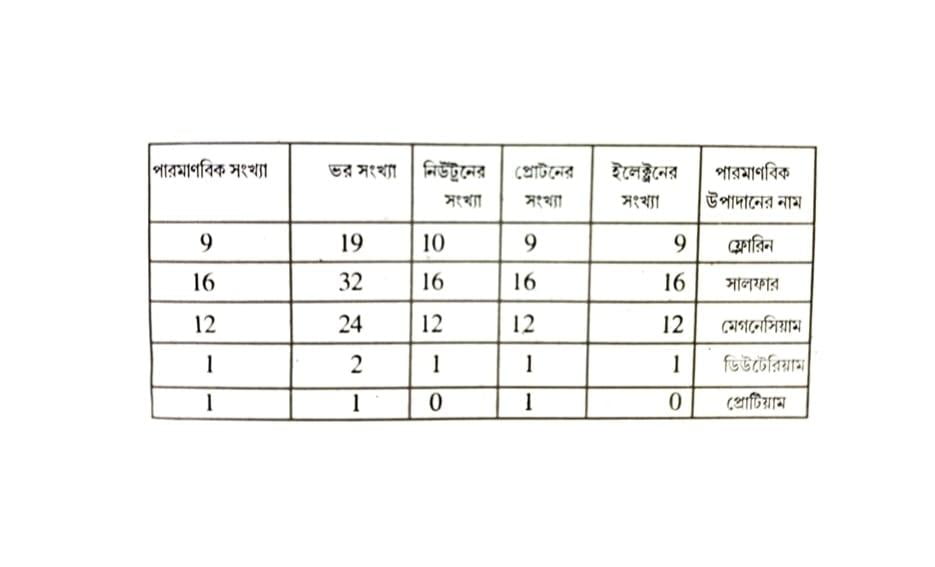
প্রশ্ন ১৯। নিম্নোক্ত তালিকাটি পূর্ণ কর।
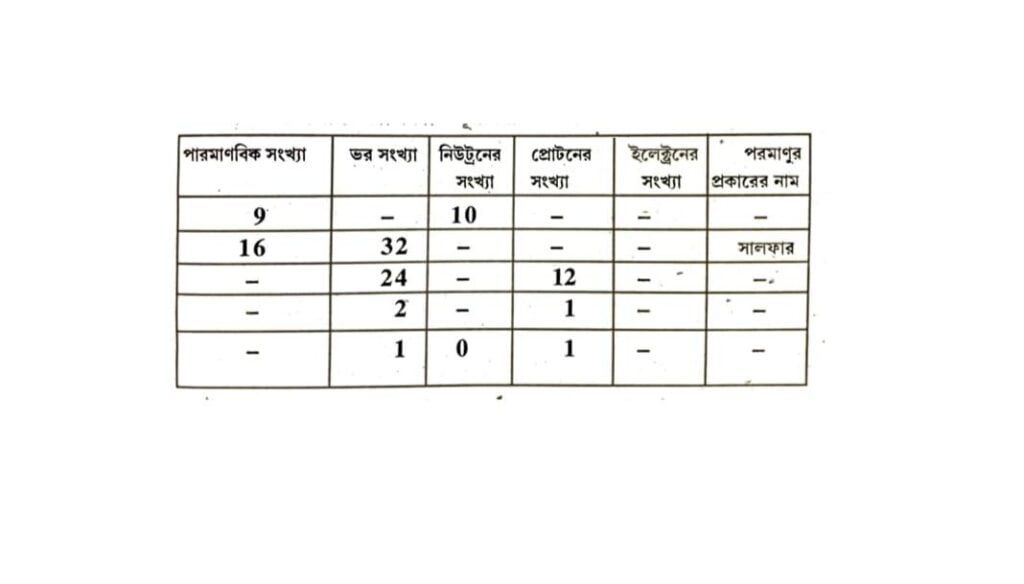
উত্তরঃ
অতিরিক্ত প্রশ্নোত্তরঃ
প্রশ্ন ১। কোন বিজ্ঞানী পরীক্ষার দ্বারা প্রমাণ করেন যে পরমাণুর মধ্যে ধনাত্মক আধানগ্রস্ত নিউক্লিয়াস বর্তমান।
উত্তরঃ রাদারফোর্ড।
প্রশ্ন ২। একটি ইলেকট্রনের ভর কত ?
উত্তরঃ 9.1083 × 10⁻31 kg।
প্রশ্ন ৩। টেলিভিশনে কোন ধরনের রশ্মি ব্যবহৃত হয় ?
উত্তরঃ টেলিভিশনে ক্যাথোড রশ্মি ব্যবহৃত হয়।
প্রশ্ন ৪। নিউট্রন ও প্রোটনের মধ্যে কোন্টি ভারী ?
উত্তরঃ নিউট্রন ভারী।
প্রশ্ন ৫। X – রশ্মির আধানের প্রকৃতি কী ?
উত্তরঃ X -রশ্মি নিস্তড়িৎ।
প্রশ্ন ৬। একটি প্রোটন একটি ইলেকট্রনের তুলনায় কতগুণ ভারী ?
উত্তরঃ 1837 গুণ।
প্রশ্ন ৭। সালফারের একটি পরমাণুর মধ্যে নিউট্রনের সংখ্যা কত ?
উত্তরঃ 16
প্রশ্ন ৮। যোজ্যতা ইলেকট্রন কী ?
উত্তরঃ পরমাণু সর্ববহিঃস্থ কক্ষের ইলেকট্রনগুলিকে যোজ্যতা ইলেকট্রন বলে।
প্রশ্ন ৯। রাদারফোর্ড a কণার বিচ্ছুরণ পরীক্ষার পর্যবেক্ষণগুলি লক্ষ্য করে কি সিদ্ধান্তে উপনীত হয়েছিলেন তা ব্যাখ্যা কর।
উত্তরঃ রাদারফোর্ড a কণার বিচ্ছুরণ পরীক্ষার পর্যবেক্ষণ থেকে এই সিদ্ধান্তে উপনীত হন যে-
(i) পরমাণুর ভেতরের বেশির ভাগ স্থানই খালি বা ফাঁকা কারণ অধিকাংশ আলফা (a) কণাই সোনার পাতের মধ্য দিয়ে বেরিয়ে যায়, এদের গতিপথের কোনো বিচ্যুতি ঘটে না।
(ii) খুব কম সংখ্যক কণা ওদের গতিপথ থেকে বিচ্যুত হয়। তাই এটা থেকে বোঝা যায় যে পরমাণুর আধান খুব কম জায়গা দখল করে থাকে।
(iii) অতি কম সংখ্যক আলফা (a) কণা প্রায় 180° কোণে ঘুরে আসে। এই পর্যবেক্ষণ থেকে বোঝা যায় যে সোনার পরমাণুর মোট ভর এবং ধনাত্মক আধান পরমাণুর ভেতরে অতি অল্প আয়তনে কেন্দ্রীভূত হয়ে থাকে।
প্ৰশ্ন ১০। রাদারফোর্ডের প্রস্তাবিত পরমাণুর নিউক্লীয় মডেলের বৈশিষ্ট্যগুলি উল্লেখ কর।
উত্তরঃ রাদারফোর্ডের প্রস্তাবিত পরমাণুর নিউক্লীয় মডেলের বৈশিষ্ট্যগুলি হল-
(ক) পরমাণুতে ধনাত্মক আধানযুক্ত একটি কেন্দ্র আছে যাকে নিউক্লিয়াস বলা হয়। পরমাণুর প্রায় সমস্ত ভরই নিউক্লিয়াসে পুঞ্জীভূত হয়ে থাকে।
(খ) ইলেকট্রনগুলি নিউক্লিয়াসের চারদিকে সুস্পষ্ট কক্ষপথে ঘোরে।
(গ) পরমাণুর আকারের তুলনায় নিউক্লিয়াসের আকার খুবই ছোট।
প্রশ্ন ১১। পরমাণুর বিভিন্ন কক্ষপথে ইলেকট্রনের বিন্যাস সম্পর্কে বোর-বুরী প্রকল্পের নিয়মগুলি লেখ।
উত্তরঃ পরমাণুর বিভিন্ন কক্ষপথে ইলেকট্রনের বিন্যাস সম্পর্কে নীলস্ বোর এবং বুরী একটি প্রকল্প প্রস্তুত করেন। এটিকে বোর-বুরী প্রকল্প বলা হয়। প্রকল্পটির নিয়মগুলি নীচে উল্লেখ করা হল-
(i) পরমাণুর যে কোনো কক্ষপথে সর্বাধিক 2n² সংখ্যক ইলেকট্রন থাকতে পারে। ‘n’ হল শক্তিস্তরের ক্রমিক সংখ্যা 1, 2, 3 বা কক্ষপথের সংখ্যা। এই নিয়ম অনুসারে পরমাণুর প্রথম, দ্বিতীয়, তৃতীয় এবং চতুর্থ শক্তিস্তরে অর্থাৎ K, L, M, N, শক্তিস্তরে স্থান পাওয়া ইলেকট্রনের সর্বাধিক সংখ্যাগুলি হচ্ছে যথাক্রমে 2, 8, 18 এবং 32 ।
(ii) পরমাণুর একেবারে বাইরের কক্ষে সর্বাধিক ৪ (আট) টির বেশি ইলেকট্রন থাকতে পারে না।
(iii) কোনো একটি পরমাণুর নিম্নতর শক্তির খোলের ইলেকট্রন বিন্যাস পূর্ণ না হওয়া পর্যন্ত উচ্চতর শক্তির খোলে কোনো ইলেকট্রন প্রবেশ করতে পারে না।
প্রশ্ন ১২। বোরের পরমাণু মডেলের স্বীকার্যগুলি লিখ।
উত্তরঃ রাদারফোর্ডের পরমাণু মডেলটির অসংগঠিত বা অসুবিধাগুলি দূর করার জন্য নীলস্ বোর পরমাণুর মডেল সম্বন্ধে কয়েকটি স্বীকার্য প্রস্তাব করেন। সেগুলি হল-
(i) পরমাণুর ভেতরে কেবল কতকগুলি বিশেষ কক্ষপথ থাকে। এই কক্ষপথগুলিকে ইলেকট্রনের অসংলগ্ন কক্ষপথ বলা হয়।
(ii) ইলেকট্রনগুলি অসংলগ্ন কক্ষপথে ঘোরার সময় কোনো শক্তি বিকিরণ করে না।
প্রশ্ন ১৩। কোনো মৌলের যোজ্যতা কিভাবে নির্ধারিত হয় তা ব্যাখ্যা কর।
উত্তরঃ প্রত্যেকটি মৌলের একটি পরমাণুর নির্দিষ্ট যোজন ক্ষমতা আছে যাকে যোজ্যতা বলা হয়। আমরা জানি যে, কোনো পরমাণুর বহিকক্ষে সর্বাধিক ৪টি ইলেকট্রন থাকতে পারে। ৪টি ইলেকট্রন বহির্বক্ষটিকে অষ্টক বিন্যাস বলে। এই অষ্টক বিন্যাস লাভ করার জন্যই পরমাণুগুলির রাসায়নিক বিক্রিয়া ঘটে। মৌলের পরমাণুগুলি যে সংখ্যক ইলেকট্রন গ্রহণ করে বা ত্যাগ করে বা সমভাগ করে তার বহিকক্ষে অষ্টক বিন্যাস লাভ করে সেই সংখ্যাটি মৌলের যোজ্যতা প্রকাশ করে। উদাহরণস্বরূপ, সোডিয়াম পরমাণুর যোজ্যতা এক কারণ সোডিয়াম পরমাণুটি অন্য পরমাণুর সঙ্গে যোজিত হওয়ার সময় তার বহিকক্ষে থাকা 1টি ইলেকট্রন হারিয়ে অষ্টক বিন্যাস লাভ করে। একইভাবে মেগনেসিয়াম ও এলুমিনিয়ামের যোজ্যতা যথাক্রমে 2 এবং 3 কারণ মেগনেসিয়াম-এর বহিকক্ষে ২টি ইলেকট্রন এবং এলুমিনিয়ামের বহিকক্ষে 3টি ইলেকট্রন আছে। আবার যদি কোনো মৌলের পরমাণুর বহিকক্ষের ইলেকট্রনের সংখ্যা ঐ কক্ষের ইলেকট্রনের সর্বাধিক সংখ্যা 8 এর কাছাকাছি হয় অর্থাৎ 5, 6 বা 7 হয় তাহলে সেই মৌলের যোজ্যতা নির্ণয় করতে অষ্টকের ৪টি ইলেকট্রন থেকে যোজক ইলেকট্রন সংখ্যা বিয়োগ করতে। হয়। যেমন অক্সিজেন পরমাণুর বহিকক্ষে থাকা ইলেকট্রনের সংখ্যা অর্থাৎ যোজক ইলেকট্রন সংখ্যা 6। কিন্তু অক্সিজেনের পক্ষে 6টি ইলেকট্রন ত্যাগ করার চেয়ে, 2টি ইলেকট্রন গ্রহণ করে অষ্টক বিন্যাস লাভ করা সহজ। সেজন্য অক্সিজেনের যোজ্যতা (8-6) = 2। একইভাবে আমরা ক্লরিন, সালফা-এর যোজ্যতা নির্ণয় করতে পারি।
প্রশ্ন ১৪। শূন্যযোজী তিনটি মৌলের নাম লেখ।
উত্তরঃ হিলিয়াম, নিয়ন, আর্গন।
প্রশ্ন ১৫। নিউট্রন কণা কে আবিষ্কার করেন? এই কণার, বৈশিষ্ট্য কি ?
উত্তরঃ 1932 সালে জে চ্যাডউইক নিউট্রন কণা আবিষ্কার করেন। এই কণাটি আধানহীন এবং এর ভর একটি প্রোটনের ভরের প্রায় সমান।
প্রশ্ন ১৬। ইলেকট্রন এবং প্রোটন এই কণা দুইটির আবিষ্কারকের নাম লিখ।
উত্তরঃ ইলেকট্রন আবিষ্কারকের নাম জে. জে. থমসন, প্রোটন আবিষ্কারকের নাম ই. গোল্ডষ্টিন।
প্রশ্ন ১৭। নিম্নলিখিত মৌলগুলির ইলেকট্রনীয় বিন্যাস দেখাও এবং যোজ্যতা কত উল্লেখ কর।
সোডিয়াম, বেরিলিয়াম, বোরন, সিলিকন, ফ্লরিন, নাইট্রোজেন, ফসফরাস।
উত্তরঃ (i) সোডিয়াম-এর পারমাণবিক সংখ্যা = 11.
∴ সোডিয়াম-এর ইলেকট্রনীয় বিন্যাস = 2, 8, 1.
সোডিয়াম-এর যোজ্যতা = 1
(ii) বেরিলিয়াম-এর পারমাণবিক সংখ্যা = 4
∴ বেরিলিয়াম-এর ইলেকট্রনীয় বিন্যাস = 2, 2
বেরিলিয়াম-এর যোজ্যতা = 2
(iii) বোরন-এর পারমাণবিক সংখ্যা = 5
∴ বোরন-এর ইলেকট্রনীয় বিন্যাস = 2, 3
বোরন-এর যোজ্যতা = 3
(iv) সিলিকন-এর পারমাণবিক সংখ্যা = 14
∴ সিলিকন-এর ইলেকট্রনীয় বিন্যাস = 2, 8, 4
সিলিকন-এর যোজ্যতা = 4
(v) ফ্লরিন-এর পারমাণবিক সংখ্যা = 9
ফ্লরিন-এর ইলেকট্রনীয় বিন্যাস = 2, 7
ফ্লরিন-এর যোজ্যতা = 8 -7 = 1
(vi) নাইট্রোজেন-এর পারমাণবিক সংখ্যা = 7
নাইট্রোজেন-এর ইলেকট্রনীয় বিন্যাস = 2, 5
নাইট্রোজেন-এর যোজ্যতা = 8 – 5 = 3
(vii) ফসফরাস-এর পারমাণবিক সংখ্যা = 15
ফরফসার-এর ইলেকট্রনীয় বিন্যাস = 2, 8, 5
ফসফরাস-এর যোজ্যতা = 8 – 5 = 3
প্রশ্ন ১৮। যদি কোনো মৌলের ভর সংখ্যা 18 এবং এটিতে 7 টি ইলেকট্রন থাকে তাহলে মৌলের পরমাণুটির প্রোটন ও নিউট্রনের সংখ্যা কত ? মৌলটির পারমাণবিক সংখ্যা কত হবে ?
উত্তরঃ (i) প্রোটন সংখ্যা = ইলেকট্রন সংখ্যা = 7
(ii) নিউট্রন সংখ্যা = ভর সংখ্যা – প্রোটন সংখ্যা = 18 -7 = 11
(iii) পারমাণবিক সংখ্যা = ইলেকট্রন সংখ্যা = 7
প্রশ্ন ১৯। নীচের তথ্যগুলির মধ্যে যেগুলি সঠিক সেগুলির পাশে T এবং যেগুলি ভুল সেগুলির পাশে F লেখো।
(i) নিউক্লিয়াসের ঘনত্ব খুব কম।
উত্তরঃ (F)
(ii) a কণা হল ধণাত্মক আধানগ্রস্ত কণা।
উত্তরঃ (T)
(iii) পরমাণুর বেশির ভাগ স্থান ফাঁকা।
উত্তরঃ (T)
(iv) কার্বণ পরমাণুর নিউক্লিয়াসের সংখ্যা 6
উত্তরঃ (F)
(v) ক্লোরিণ পরমাণুর যোজ্যতা 7
উত্তরঃ (F)
(vi) K কক্ষে সর্বোচ্চ ইলেকট্রন 8টি।
উত্তরঃ (F)
(vii) ইলেকট্রন ঋণাত্মক আধান বহন করে।
উত্তরঃ (T)
(viii) একটি প্রোটনের ভর একটি ইলেকট্রনের ভরের প্রায় 1840 গুণ।
উত্তরঃ (T)
(ix) পারমাণবিক সংখ্যা হল গড় পরিমাণ।
উত্তরঃ (F)
(x) জেমস স্যাডউইক নিউট্রন কণিকা আবিষ্কার করেন।
উত্তরঃ (T)
(xi) নিউট্রনের কোনো আধান নেই।
উত্তরঃ (T)
(xii) যে কোনো পরমাণুর সর্ববহিঃস্থ কক্ষে সর্বোচ্চ ইলেকট্রনের সংখ্যা হল 2
উত্তরঃ (F)
প্রশ্ন ২০। সঠিক উত্তরটি বেছে নিয়ে খাতায় লেখো।
(a) ম্যাগনেসিয়াম পরমাণুর সঠিক ইলেকট্রন বিন্যাসটি হল—
(a) 8, 2, 2
(b) 2, 8, 2
(c) 3, 8, 1
(d) 1, 8, 3
উত্তরঃ (b) 2, 8, 2
(b) রাদারফোর্ডের a কণা বিচ্ছুরণ পরীক্ষা নীচের কোন কণিকার আবিষ্কারে সাহায্য করে।
(a) প্রোটন।
(b) পারমাণবিক ভর।
(c) পরমাণুর নিউক্লিয়াস।
(d) ইলেকট্রন।
উত্তরঃ (c) পরমাণুর নিউক্লিয়াস।
(c) একটি পরমাণুর ইলেকট্রন সংখ্যা 15 এবং নিউট্রন সংখ্যা 16। নীচের কোনটির দ্বারা পরমাণুটিকে সঠিকভাবে প্রকাশ করা যাবে ?
(a) ₁₅X³¹
(b) ₁₆X¹⁵
(c) ᶜX³
(d) ₁₅X¹⁶
উত্তরঃ (a) ₁₅X³¹
(d) ইথাইল ইথানোয়েটের একটি নমুনাতে দুটি অক্সিজেন পরমাণুর ইলেকট্রন সংখ্যা সমান কিন্তু ভর সংখ্যা আলাদা এর সঠিক কারণ কী ?
(a) অক্সিজেন পরমাণু দুটি পরস্পরের আইসোবার।
(b) অক্সিজেন পরমাণুগুলির একটি দুটি নিউট্রন লাভ করেছে।
(c) অক্সিজেন পরমাণু দুটি পরস্পরের সমস্থানিক।
(d) অক্সিজেন পরমাণুগুলির একটি ইলেকট্রন লাভ করেছে।
উত্তরঃ (c) অক্সিজেন পরমাণু দুটি পরস্পরের সমস্থানিক।
(e) 1 যোজ্যতা বিশিষ্ট মৌলগুলি হল-
(a) সর্বদা অধাতু।
(b) সর্বদা ধাতুকল্প।
(c) হয় ধাতু অথবা অধাতু।
(d) সর্বদা ধাতু।
উত্তরঃ (d) সর্বদা ধাতু ।
(f) পরমাণুর সম্বন্ধে কোন তথ্যটি সঠিক ?
(a) গ্লোল্ডস্টাইনের তত্ত্ব।
(b) রাদারফোর্ডের তত্ত্ব।
(c) নীলস বোরের তত্ত্ব।
(d) জে জে থমসনের তত্ত্ব।
উত্তরঃ (d) জে জে থমসনের তত্ত্ব।
(g) একটি পরমাণুর 3টি প্রোটন ও 4টি নিউট্রন আছে। এর যোজ্যতা হল-
(a) 4
(b) 7
(c) 1
(d) 3
উত্তরঃ (c) 1
(h) অ্যালুমিনিয়াম পরমাণুর ইলেকট্রন বিন্যাস-
(a) 2, 8, 3
(b) 2, 3, 8
(c) 2, 8, 2
(d) 8, 2, 3
উত্তরঃ (a) 2, 8, 3
(9) নীচের কোন তথ্যটি সর্বদা ঠিক ?
(a) একটি পরমাণুর প্রোটন সংখ্যা ও ইলেকট্রন সংখ্যা সর্বদা সমান।
(b) একটি পরমাণুর প্রোটন সংখ্যা ও নিউট্রন সংখ্যা সমান।
(c) একটি পরমাণুর প্রোটন, ইলেকট্রন ও নিউট্রন সংখ্যা সমান।
(d) একটি পরমাণুর ইলেকট্রন ও নিউট্রন সংখ্যা সমান।
উত্তরঃ (a) একটি পরমাণুর প্রোটন সংখ্যা ও ইলেকট্রন সংখ্যা সর্বদা সমান।
(j) সমস্থানিক হচ্ছে।
(a) একই ভর সংখ্যার বিভিন্ন মৌলের নিউক্লাইড।
(b) বিভিন্ন মৌলের বিভিন্ন ভর সংখ্যার নিউক্লাইড।
(c) একটি মৌলের বিভিন্ন ভর সংখ্যার নিউক্লাইড।
উত্তরঃ (b) বিভিন্ন মৌলের বিভিন্ন ভর সংখ্যার নিউক্লাইড।
(k) পারমাণবিক ভর এককে প্রোটনের ভর-
(a) 5.48 × 10⁻⁴
(b) 1.00728u
(c) 1.00866
উত্তরঃ (b) 1.00728u
(l) অক্সাইড আয়ন O² তে থাকা যোজক ইলেকট্রনের সংখ্যা-
(a) 2,
(b) 0,
(c) 8
উত্তরঃ (c) 8
(m) একটি মাত্র সমস্থানিকের প্রকৃতিতে পাওয়া মৌল-
(a) ফ্লোরিন।
(b) অক্সিজেন।
(c) নিয়ন।
উত্তরঃ (a) ফ্লোরিন।
(n) ইলেকট্রনে থাকা আধানের মান
(a) -4.803 x 14⁻¹⁹ কুলম্ব।
(b) -1.602 x 10⁻¹⁹ কুলম্ব।
(c) -1.602 × 10⁻¹⁹ কুলম্ব।
উত্তরঃ (b) -1.602 × 10⁻¹⁹ কুলম্ব।
প্রশ্ন ২১। শূন্যস্থান পূরণ কর।
(a) পরমাণুর গঠন হয়………………, ………..………. এবং………..…….. দ্বারা।
উত্তরঃ ইলেকট্রন, প্রোটন, নিউট্রন।
(b) ইলেকট্রন ………………… আধানযুক্ত কণিকা এবং এর ভর হাইড্রোজেনের পরমাণু ভরের……………….. ভাগ।
উত্তরঃ ঋণাত্মক, 1/1837
(c) প্রোটন ধনাত্মক আধানযুক্ত কণিকা এবং এর ভর ………………….পরমাণুর ভরের সমান।
উত্তরঃ হাইড্রোজেনের।
(d) একটি পারমাণবিক সংখ্যা যুক্ত বিভিন্ন ভর সংখ্যার মৌলকে ………………..বলা হয়।
উত্তরঃ সমস্থানিক।
(e) পরমাণুর ইলেকট্রন বৃত্তাকার পথে………………….. চারদিকে ঘোরে।
উত্তরঃ নিউক্লিয়াসের।

Hi! my Name is Parimal Roy. I have completed my Bachelor’s degree in Philosophy (B.A.) from Silapathar General College. Currently, I am working as an HR Manager at Dev Library. It is a website that provides study materials for students from Class 3 to 12, including SCERT and NCERT notes. It also offers resources for BA, B.Com, B.Sc, and Computer Science, along with postgraduate notes. Besides study materials, the website has novels, eBooks, health and finance articles, biographies, quotes, and more.



