Class 9 Science Chapter 4 পৰমাণুৰ গঠন, নৱম শ্ৰেণীৰ বিজ্ঞান প্ৰশ্নৰ উত্তৰ, Class 9 Science Question Answer to each chapter is provided in the list of SEBA বিজ্ঞান Class 9 Question Answer so that you can easily browse through different chapters and select needs one. Class 9 Science Chapter 4 পৰমাণুৰ গঠন Question Answer can be of great value to excel in the examination.
Class 9 Science Chapter 4 পৰমাণুৰ গঠন
SEBA Class 9 General Science Chapter 4 পৰমাণুৰ গঠন Notes cover all the exercise questions in Assam Board SEBA Textbooks. The SEBA Class 9 Science Chapter 4 পৰমাণুৰ গঠন provided here ensures a smooth and easy understanding of all the concepts. Understand the concepts behind every chapter and score well in the board exams.
পৰমাণুৰ গঠন
Chapter – 4
পাঠভিত্তিক ক্রিয়াকলাপৰ প্রশ্নোত্তৰ
1. কেনেল ৰশ্মি কি ?
উত্তৰঃ বিদ্যুত মোক্ষন নলী এটাত অতি কম চাপত বিদ্যুৎ প্রবাহিত কৰিলে এনডৰ পৰা কেথডলৈ সৰল ৰেখাত কিছুমান ৰশ্মি গতি কৰে। এই ৰশ্মিবোৰ নলীটোৰ ভিতৰত থকা গেছৰ ধণাত্মক আধান বিশিষ্ট অণু বা পৰমাণুৰ দ্বাৰা গঠিত। এই ৰশ্মিবোৰক কেনেল ৰশ্মি বোলে।
2. পৰমাণু এটাত এটা প্ৰ’টন আৰু এটা ইলেকট্রন থাকিলে ই কোনো আধান বহন কৰিবনে নকৰে?
উত্তৰঃ নকৰে। ই কোনো আধান বহন নকৰে।
প্রশ্নাৱলী
1. থমছনৰ পৰমাণুৰ আৰ্হিৰ মতে পৰমাণু এটা সামগ্ৰিকভাৱে কেনেদৰে প্রশম হয় ব্যাখ্যা কৰা।
উত্তৰঃ থমছনৰ মতে,
(i) পৰমাণু এটা ধণাত্মকভাৱে আহিত একোটা গোলক আৰু ইলেকট্রনবোৰ ইয়াত সোমাই থাকে।
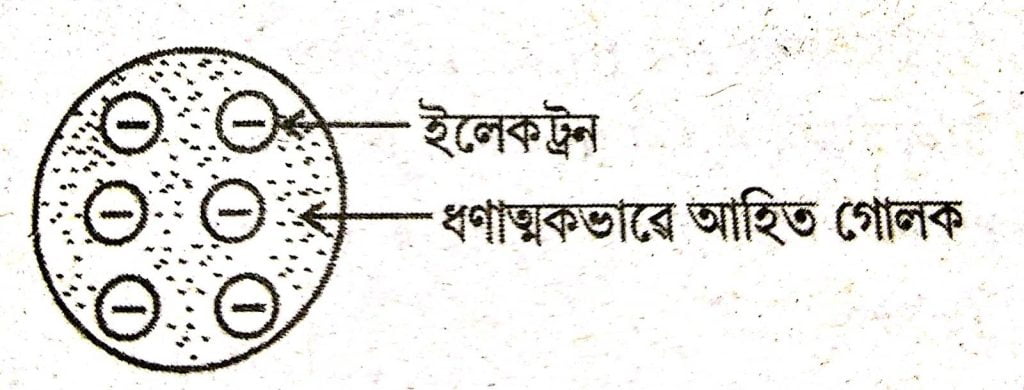
ঋণাত্মক আৰু ধণাত্মক আধান মানত সমান। সেইবাবে পৰমাণু এটা বৈদ্যুতিকভাৱে প্রশম।
2. ৰাডাফ’ৰ্ডৰ পৰমাণুৰ আৰ্হিৰ মতে পৰমাণুৰ নিউক্লিয়াছত কোনটো উপ-পাৰমাণবিক কণা থাকে।
উত্তৰঃ প্রটন।
3. তিনিটা শ্বেলৰে সৈতে ব’ৰৰ পৰমাণুৰ আৰ্হিৰ এটা চিত্র অংকন কৰা ।
উত্তৰঃ
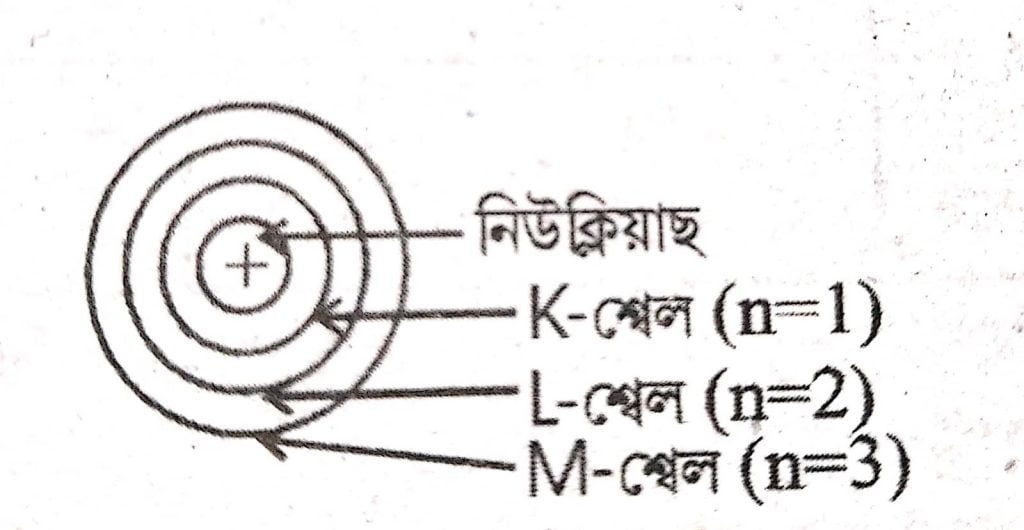
চিত্রঃ ব’বৰ পৰমাণুৰ আৰ্হি
4. যদি a. -কণা বিচ্ছুৰণ পৰীক্ষাটোত সোণৰ পাতৰ সলনি আন ধাতুৰ পাত ব্যৱহাৰ কৰা তেনেহ’লে কি দেখা যাব বুলি ভাবা?
উত্তৰঃ প্রায় সকলোবোৰ a. কণা বিক্ষেপিত নোহোৱাকৈ পাৰ হৈ যাব আৰু খুব কম ox -কণাহে বিক্ষেপিত হ’ব পাৰে।
প্রশ্নাৱলী
1.পাৰমাণুৰ তিনিটা উপ-পাৰমাণবিক কণাৰ নাম
লিখা।
উত্তৰঃ (i) ইলেকট্রন।
(ii) প্ৰটন।আৰু
(iii) নিউট্রন।
2. হিলিয়াম পৰমাণুৰ পাৰমাণৱিক ভৰ 4u ইয়াৰ নিউক্লিয়াছত দুটা প্ৰটন আছে। ইয়াত কিমানটা নিউট্রন থাকিব?
উত্তৰঃ হিলিয়ামৰ পাৰমাণৱিক ভৰ = 4u প্রটনৰ সংখ্যা = 2
∴ নিউট্রনৰ সংখ্যা = 4 –2=2
প্রশ্নাৱলী
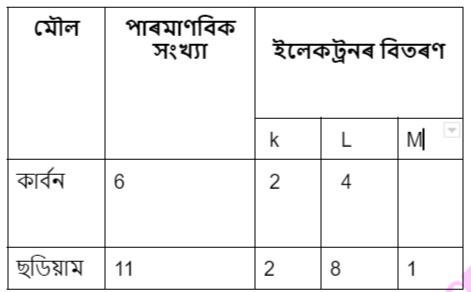
1. কাৰ্বন আৰু ছডিয়াম পৰমাণুৰ ইলেকট্ৰনৰ বিতৰণ দেখুওৱা
উত্তৰঃ
2. পৰমাণু এটাৰ K আৰু L খেলবোৰ পূৰ্ণ হৈ থাকিলে পৰমাণুটোত ইলেকট্রনৰ মুঠ সংখ্যা কিমান হ’ব?
উত্তৰঃ K – শ্বেলত থকা ইলেকট্রনৰ সংখ্যা = 2 টা
L – শ্বেলত থকা ইলেকট্ৰনৰ সংখ্যা = ৪ টা
∴ মুঠ ইলেকট্রন = 2 + 8 = 10 টা
প্রশ্নাৱলী
1. ক্লৰিণ, ছালফাৰ আৰু মেগনেছিয়ামৰ যোজ্যতা কেনেদৰে পাবা?
উত্তৰঃ ক্লৰিণৰ ইলেকট্রনীয় বিন্যাস = 2, 8,7
∴ কুৰিণৰ যোজ্যতা =8-7=1
ছালফাৰৰ ইলেকট্রনীয় বিন্যাস = 2, 8, 6
∴ ছালফাৰৰ যোজ্যতা = 8-6 = 2
মেগনেছিয়ামৰ ইলেকট্রনীয় বিন্যাস = 2, 8, 2
∴ মেগনেছিয়াম যোজ্যতা = 2
প্রশ্নাৱলী
1. যদি পৰমাণু এটাত ইলেকট্ৰনৰ সংখ্যা ৪ আৰু প্ৰটনৰ সংখ্যাত ৪ হয় তেন্তে,
(i) পৰমাণুটোৰ পাৰমাণবিক সংখ্যা কি হ’ব? আৰু
(ii) পৰমাণুটোৰ আধান কিমান হ’ব?
উত্তৰঃ প্ৰটনৰ সংখ্যা = 8
∴ পাৰমাণৱিক সংখ্যা = 8
(ii) আধান শূণ্য হ’ব।
2.অক্সিজেন আৰু ছালফাৰ পৰমাণুৰ ভৰ সংখ্যা উলিওৱা ।
উত্তৰঃ অক্সিজেনৰ পৰমাণুত থকা
প্ৰটনৰ সংখ্যা = 8
নিউট্রনৰ সংখ্যা = ৪
∴ পৰমাণুৰ ভৰ সংখ্যা = 8 +8 = 16
ছালফাৰৰ পৰমাণুত থকা
প্লটনৰ সংখ্যা = 16
নিউট্রনৰ সংখ্যা = 16
∴ পৰমাণুৰ ভৰ সংখ্যা = 16 +16 = 32
প্রশ্নাৱলী
1. চিহ্ন H, D আৰু T প্ৰতিটোতে পোৱা উপ পাৰমাণৱিক কণাবোৰ তালিকাভূক্ত কৰা।
উত্তৰঃ
| মৌলৰচিহ্ন | পাৰমাণৱিকসংখ্যা | ভৰসংখ্যা | ইলেকট্রনৰসংখ্যা | প্ৰটনৰ সংখ্যা | নিউট্রনৰ সংখ্যা |
| H | 1 | 1 | 1 | 1 | 0 |
| D | 1 | 2 | 1 | 1 | 1 |
| T | 1 | 3 | 1 | 1 | 2 |
2. একোযোৰকৈ সমস্থানিক আৰু সমভাৰীৰ ইলেকট্ৰনীয বিন্যাস লিখা।
উত্তৰঃ সমস্থানিকঃ ³⁵₁₇c৷ আৰু ³²₁₇cl
ক্লৰিণৰ (cl) পাৰমাণৱিক সংখ্যা = 17
∴ ক্লৰিণৰ ইলেকট্রনীয় বিন্যাস = 2, 8, 7
সমভাৰীঃ ⁴⁰₁₉ Ar আৰু ⁴⁰₁₉ k
আগনৰ (Ar) পাৰমাণৱিক সংখ্যা = 18
∴ আগনৰ ইলেকট্রনীয় বিন্যাস = 2, 8, 8
পটেছিয়ামৰ (k) পাৰমাণবিক সংখ্যা = 19
∴ পটেছিয়ামৰ ইলেকট্রনীয় বিন্যাস = 2, 8, 8, 1
অনুশীলনীঃ
1. ইলেকট্রন, প্ৰটন আৰু নিউট্ৰনৰ ধৰ্মসমূহ তুলনা কৰা।
উত্তৰঃ ইলেকট্রন, প্রটন আৰু নিউট্রনৰ ধৰ্মঃ
| ইলেকট্রন | প্রটন | নিউট্রন | |
| বিদ্যুতি প্রকৃতি | ঋণাত্মক | ধনাত্মক | প্রশম |
| আধানৰ মান(কুলম্ব) | -1.602×10⁻¹⁹ | +1.602×10⁻¹⁹ | 0 |
| ( ভৰ (গ্রাম) | 9.109 × 10⁻²⁸ | 1.625 × 10⁻¹⁰ | 1.675 ×10⁻²⁴ |
2. জে জে থমছনৰ পৰমাণুৰ আৰ্হিৰ সীমাবদ্ধতাসমূহ কি কি?
উত্তৰঃ (i) ই পৰমাণুৰ স্থিৰতা সম্পর্কে ব্যাখ্যা আগবঢ়াব পৰা নাছিল।
(ii) ইহাইড্ৰজেন বৰ্ণালীৰ ব্যাখ্যা আগবঢ়াব পৰা নাছিল।
3. ৰাজৰ ফ’ৰ্ডৰ পৰমাণুৰ আৰ্হিৰ সীমাবদ্ধতাসমূহ কি কি ?
উত্তৰঃ (i) ই পৰমাণুৰ সুস্থিৰতাৰ ব্যাখ্যা আগবঢ়াব পৰা নাছিল।
(ii) ইহাইড্ৰ’জেন বৰ্ণালীৰ ব্যাখ্যা আগবঢ়ায়।
4. ব’ৰৰ পৰমাণুৰ আৰ্হিটো বৰ্ণনা কৰা।
উত্তৰঃ ব’ৰে পৰমাণুৰ আৰ্হিটো তলত দিয়া প্ৰকল্পবোৰৰ ওপৰত ভিত্তি কৰি দিছিল—
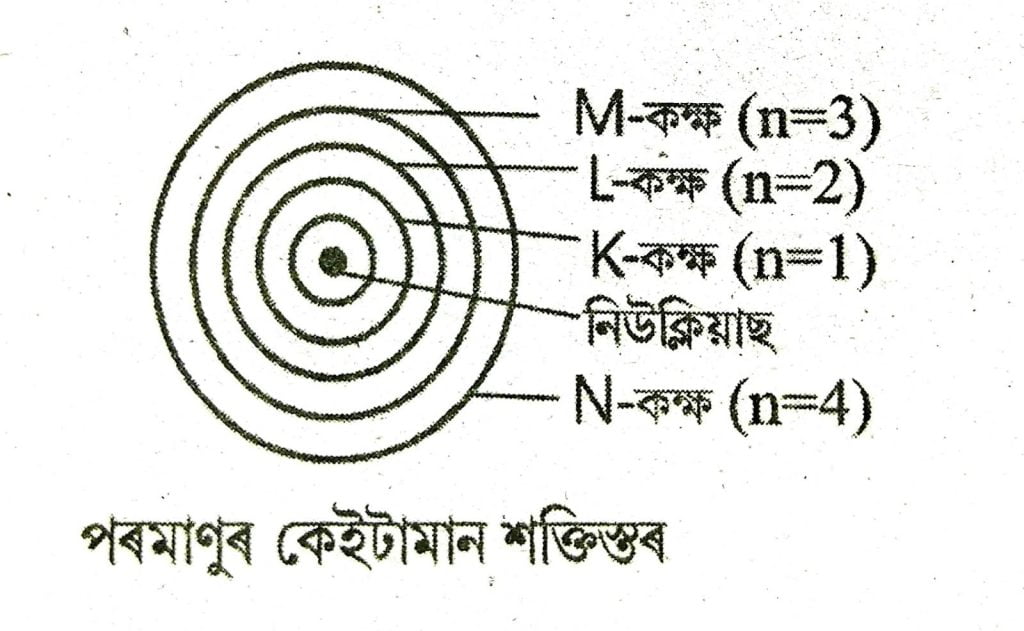
(i) পৰমাণু এটাৰ ইলেকট্রনবোৰে নিউক্লিয়াছটোৰ চাৰিওফালে থকা কিছুমান নিৰ্দিষ্ট বৃত্তাকাৰ কক্ষপথত ঘুৰি থাকে। এই কক্ষপথবোৰক স্থিৰ কক্ষপথ বা শক্তিস্তৰ বুলি কোৱা হয়।
(ii) প্ৰতিটো শক্তিক্তৰত নিহিত থকা শক্তিৰ পৰিমাণ নিৰ্দিষ্ট। শক্তিস্তৰবোৰক K, L, M, N………বা 1, 2, 3, সংখ্যাৰ দ্বাৰা বুজোৱা হয়। নিউক্লিয়াছৰ একেবাৰে ওচৰত শক্তিস্তৰটোৰ শক্তি নিম্নতম। নিউক্লিয়াছ পৰা আতৰি যোৱাৰ লগে লগে ওপৰলৈ কক্ষপথবোৰৰ শক্তি ক্রমান্বয়ে বাঢ়ি গৈ থাকে। অর্থাৎ পৰমাণু এটাত কক্ষপথবোৰৰ শক্তি বাঢ়ি যোৱাৰ ক্ৰমটো হৈছে K<L<M<N……
(iii) নিৰ্দিষ্ট কক্ষপথ এটাত ঘুৰি থাকোতে ইলেট্রন এটাত নিৰ্দিষ্ট পৰিমাণৰ শক্তি নিহিত হৈ থাকে। গতিকে স্থিৰ কক্ষপথ এটাত ঘূৰি থকা অবস্থাত ইলেক্ট্রন এটাই শক্তিৰ অৱশোষণ বা বিকিৰণ নকৰে।
(iv) এটা কক্ষপথৰ পৰা অন্য এটা কক্ষপথলৈ ইলেকট্রন এটাই জপিয়ালে নিৰ্দিষ্ট পৰিমাণৰ শক্তি অবশোষণ বা বিকিৰণ কৰিব। তলৰ কক্ষপথৰ পৰা ওপৰৰ কক্ষপথলৈ গ’লে ইলেকট্রনে শক্তি অৱশোষণ কৰিব আৰু ওপৰৰ কক্ষপথৰ পৰা তলৰ কক্ষপথলৈ জপিয়ালে ইলেকট্রনে শক্তি বিকিৰণ কৰিব।
5. এই অধ্যায়ত দিয়া পৰমাণুৰ আৰ্হিকেইটা তুলনা কৰা।.
উত্তৰঃ (A) থমছনৰ পৰমাণুৰ আৰ্হিঃ ধমছনৰ পৰমাণুৰ আৰ্হিৰ মতেঃ
(i) পৰমাণু এটা ধণাত্মকভাৱে আৰ্হিত একোটা গোলক আৰু ইলেকট্রনবোৰ ইয়াত সোমাই থাকে।
(ii) ঋণাত্মক আৰু ধণাত্মক আধান মানত সমান। সেইবাবে পৰমাণু এটা বৈদ্যুতিকভাৱে প্ৰশম।
(B) ৰাডাৰফৰ্ডৰ পৰমাণুৰ আৰ্হিঃ ৰাডাৰফৰ্ডৰ পৰমাণুৰ আৰ্হিৰ মতেঃ
(i) পৰমাণু এটাৰ বেছিভাগ ঠাই খালি আৰু নিউক্লিয়াছটোত পৰমাণুটোৰ গোটেই ভৰখিনি থুপ খাই থাকে।
(ii) নিউক্লিয়াছটোৰ চাৰিওফালে কিছুমান বৃত্তাকাৰ পথত ঋণাত্মক আধানযুক্ত ইলেকট্রনবোৰ ঘূৰি থাকে।
(iii) ইলেকট্রনৰ সংখ্যা নিউক্লিয়াছত থকা মুঠ আধানৰ সংখ্যাৰ সমান।
(iv) নিউক্লিয়াছ আৰু ইলেকট্ৰনৰ মাজৰ কুলম্বীয় আকৰ্ষণ আৰু ইলেকট্রনবোৰে বৃত্তাকাৰ পথত ঘূৰি থাকোতে আৱশ্যকীয় অপকেন্দ্রীক বল এই দুয়োটা সাম্যৱস্থাত থাকে।
(C) ব’ৰৰ পৰমাণুৰ আৰ্হিঃ বৰৰ পৰমাণুৰ আৰ্হিৰ মতেঃ
(i) পৰমাণুৰ ভিতৰত ইলেকট্রনৰ কিছুমান নিৰ্দিষ্ট অনুমোদিত কক্ষপথহে থাকে।
(ii) এই কক্ষপথবোৰত ঘূৰি থাকোতে ইলেকট্রনে শক্তি বিকিৰণ নকৰে।
6. প্রথম ওঠৰটা মৌলৰ কাৰণে বিভিন্ন শ্বেলত ইলেকট্রন বণ্টনৰ নিয়মবোৰ সংক্ষেপে লিখা।
উত্তৰঃ (i) পৰমাণু এটাৰ কোনো এটা কক্ষত ইলেকট্ৰনৰ
সৰ্বাধিক সংখ্যা হ’ব 2n²। ইয়াত n হ’ল শক্তিস্তৰটোৰ সংখ্যা। গতিকে,
প্রথম শক্তিস্তৰত ইলেকট্রনৰ সৰ্বাধিক সংখ্যা (n=1,kকক্ষ) = 2 ×1² = 2
দ্বিতীয় শক্তিস্তৰত ইলেকট্রনৰ সৰ্বাধিক সংখ্যা (n= 2, L কক্ষ) = 2×2² = 8
তৃতীয় শক্তিস্তৰত ইলেকট্রনৰ সৰ্বাধিক সংখ্যা (n = 3, M কক্ষ) =2×3² = 18
চতুর্থ শক্তিস্তৰত ইলেকট্রনৰ সৰ্বাধিক সংখ্যা (n = 4, N কক্ষ) =2×4² = 32 ইত্যাদি।
(ii) পৰমাণু এটাৰ বহিঃতম কক্ষত ৪টাতকৈ আৰু শেষৰ আগৰ কক্ষত 18টাতকৈ বেছি ইলেকট্রন থাকিব নোৱাৰে।
(iii) এটা কক্ষ পূৰ্ণ হোৱাৰ আগতে নতুন কক্ষ এটা ইলেকট্রনেৰে পূৰ্ণ হ’বলৈ আৰম্ভ হ’ব পাৰে।
7. চিলিকন আৰু অক্সিজেনক উদাহৰণ হিচাপে লৈ যোজ্যতাৰ সংজ্ঞা দিয়া।
উত্তৰঃ কোনো এটা ৰাসায়নিক বিক্ৰিয়াত কোনো মৌলৰ এটা পৰমাণুৱে ইয়াৰ ওচৰৰ সম্ভ্ৰাস্ত গেছৰ সজ্জা পাবলৈ যিমান সংখ্যক ইলেকট্রন এৰি দিয়ে বা গ্রহণ কৰে বা অন্য মৌলৰ পৰমাণুৰ সৈতে ভাগ কৰে সেই সংখ্যাটোকে সেই মৌলৰ যোজ্যতা বোলে। উদাহৰণস্বৰূপে –
চিলিকনৰ (Si) ইলেক্ট্রনীয় বিন্যাস – 2, 8, 4
∴ ইয়াৰ যোজ্যতা = 4
অক্সিজেনৰ (O) ইলেকট্রনীয় বিন্যাস = 2, 6
∴ ইয়াৰ যোজ্যতা = 8 – 6 = 2
8. উদাহৰণৰ সৈতে ব্যাখ্যা কৰা –
(i) পাৰমাণবিক সংখ্যা।
(ii) ভৰ সংখ্যা।
(iii) সমস্থানিক।
(iv) সমভাৰী।
সমস্থানিকৰ যিকোনো দুটা ব্যাৱহাৰ লিখা।
উত্তৰঃ (i) পাৰমাণৱিক সংখ্যা : মৌলৰ পৰমাণুত থকা প্ৰটনৰ সংখ্যাই হৈছে সেই মৌলৰ পাৰমাণৱিক সংখ্যা। পাৰমাণৱিক সংখ্যাক “Z’ চিনৰ দ্বাৰা সুচিত কৰা হয়। উদাহৰণস্বৰূপে হাইড্ৰজেনৰ পৰমাণুত 1 টা প্রটন থাকে। গতিকে হাইড্ৰ’জেনৰ পাৰমাণৱিক সংখ্যা।। পাৰমাণৱিক সংখ্যা মৌলৰ এটা মৌলিক ধর্ম।
(ii) ভৰ সংখ্যা : পৰমাণুৰ নিউক্লিয়াছত থকা প্ৰটন আৰু নিউট্ৰনৰ মুঠ সংখ্যাক ভৰ সংখ্যা বোলে। যদি পৰমাণুটোত P সংখ্যক প্ৰটন আৰু N সংখ্যক নিউট্রন থাকে তেন্তে ভৰ সংখ্যা A হ’বঃ
A = P + N
উদাহৰণস্বৰূপে, কাৰ্বনত থকা প্ৰটন আৰু নিউট্ৰনৰ সংখ্যা ক্রমে 6 আৰু 6 এতেকে কাৰ্বনৰ ভৰ সংখ্যা হ’ব 6+6 = 12
(iii) সমস্থানিক : একে পাৰমাণবিক সংখ্যাযুক্ত বিভিন্ন ভৰ সংখ্যাৰ নিউক্লাইডবোৰক সমস্থানিক বোলে। সমস্থানিকবোৰৰ ৰাসায়নিক ধর্ম একে কিন্তু ভৰ সংখ্যা বিভিন্ন হোৱাৰ বাবে ইহঁতৰ ভৌতিক ধৰ্মবোৰ যেনে – ঘনত্ব, গলনাংক, উতলাংক আদি বেলেগ হয়। উদাহৰণস্বৰূপে ক্লৰিণৰ দুটা সমস্থানিক ³⁵₁₇C আৰু ³²₁₇Cl ।
(iv) সমভাৰী : বেলেগ বেলেগ পাৰমণৱিক সংখ্যা বিশিষ্ট একে ভৰ সংখ্যাযুক্ত বেলেগ বেলেগ মৌলৰ পৰমাণুবোৰক সমভাৰী বোলা হয়। উদাহৰনস্বৰূপে আৰ্গন, পটেছিয়াম আৰু কেলছিয়ামৰ ভৰ সংখ্যা 40। কিন্তু ইহঁতৰ পাৰমাণবিক সংখ্যা যথাক্রমে 18, 19 আৰু 20। গতিকে ⁴⁰₁₈ Ar, ⁴⁰₁₉ K আৰু ⁴⁰₂₀Ca সমভাৰী।
সমস্থানিকৰ ব্যৱহাৰ :
(i) ⁶⁰₂₇Co, ²²⁵₈₈Ra আৰু ¹⁹⁸₇₈ সমস্থানিকক কৰ্কট ৰোগৰ চিকিৎসাত ব্যৱহাৰ কৰা হয়।
(ii) তীখাৰ উৎপাদনত চলা লোত থকা ফছফৰাছখিনি সম্পূর্ণভাৱে আঁতৰ হৈছে নে নাই চাবৰ কাৰণে ³²₁₅P সমস্থানিক ব্যৱহাৰ কৰা হয় ।
9. Na+ত সম্পূৰ্ণৰূপে পূৰ হৈ থকা K আৰু L খেল আছে। ব্যাখ্যা কৰা।
উত্তৰঃ Na ৰ পাৰমাণবিক সংখ্যা = 11
∴ Na ত থকা ইলেকট্ৰনৰ সংখ্যা = 11
Na⁺ ত থকা ইলেকট্রনৰ সংখ্যা = 11 – 1 = 10
Na⁺ ৰ ইলেকট্রনীয় বিন্যাস = K ₂ , L ₈
∴ Na⁺ ৰ K আৰু L শ্বেল সম্পূৰ্ণৰূপে পূৰ হৈ থাকে।
10. যদি ব্ৰ’মিন পৰমাণু ⁷⁹₃₅Br (49.7%) আৰু ⁸¹₃₅Br (50.3% ) সমস্থানিকৰ ৰূপত থাকে তেন্তে তাৰ গড় পাৰমাণৱিক ভৰ কিমান হ’ব গণনা কৰা।
উত্তৰঃ ব্ৰ’মিনৰ সমস্থানিক
দুটা ⁷⁹₃₅ Br আৰু ⁸¹₃₅ Br
(49.7%) (50.3%)
∴ ব্ৰ’মিনৰ গড় পাৰমাণৱিক ভৰ = 79×49.7+ 81× 50.3 / 100
= 3926.3+4074.3/100
= 80.0064
11. এটা মৌল X এটা নমুনাৰ গড় পাৰমাণৱিক ভৰ 16.2u । নমুনাটোত সমস্থানিক ¹⁶₈X আৰু ¹⁸₈X ৰ শকতৰা পৰিমাণ কি কি ?
উত্তৰঃ ধৰা হ’ল,
¹⁶₈Xৰ শতকৰা পৰিমাণ = P
∴ ¹⁸₈Xৰ শতকৰা পৰিমাণ= 100 – P
প্রশ্নমতে,
P×16 + (100 – P) × 18 /100 = 16.2
= 16p + 1800 -18p = 1620
= – 2p = 1620 -1800
= – 2p= -180
= p = 90
∴ ¹⁶₈ Xৰ শতকৰা পৰিমাণ = 90
¹⁸₈Xৰ শতকৰা পৰিমাণ = 100 – 90 = 10
12. যদি Z = 3 হয়, তেন্তে মৌলটোৰ যোজ্যতা কিমান হ’ব? মৌলটোৰ নাম লিখা।
উত্তৰঃ Z=3
∴পাৰমাণৱিক সংখ্যা = 3
∴ ইলেকট্ৰনৰ সংখ্যা = 3
∴ ইলেকট্রনীয় বিন্যাস = 2, 1
∴ মৌলটোৰ যোজ্যতা = 1
মৌলটোৰ নাম = লিথিয়াম
13. দুটা পৰমাণু X আৰু Yৰ নিউক্লিয়াছৰ সংযুতি তলত দিয়া হৈছে।
| X | Y |
| প্রটন = 6 | 6 |
| নিউট্রন = 6 | 6 |
X আৰু Y ৰ ভৰ সংখ্যা দিয়া। দুয়োটাৰ মাজৰ সম্পৰ্কটো কি?
উত্তৰঃ X ৰ ভৰ সংখ্যা = 6+6 =12
Y ৰ ভৰ সংখ্যা = 6+8 =14
যিহেতু দুয়োটা পৰমাণুতে থকা প্ৰটনৰ সংখ্যা একে কিন্তু ভৰ সংখ্যা বেলেগ বেলেগ গতিকে দুয়ো সমস্থানিক।
14. তলৰ শুদ্ধ উক্তিবোৰৰ ঠাইত “T” ভুলবোৰৰ ঠাইত ‘ফু’ লিখা।
(a) জে. জে. থমছনে প্ৰঙাব কৰিছিল যে পৰমাণুৰ নিউক্সিয়াছত কেৱল নিউক্লিয়ন থাকে।
উত্তৰঃ F
(b) ইলেকট্রন এটা আৰু প্ৰটন এটা লগ লাগি নিউট্রন এটা গঠন হয়। সেইবাবে ই প্রশম।
উত্তৰঃ F
(c) ইলেকট্রন এটাৰ ভৰ প্ৰটনৰ ভৰৰ প্ৰায় 1/2000 গুণ।
উত্তৰঃ T
(d) টিংচাৰ আয়ডিন প্ৰস্তুত কৰাত আয়ডিনৰ এটা সমস্থানিক ব্যৱহাৰ কৰা হয়।
উত্তৰঃ F
(e) টিংচা আয়ডিন মেডিটিন হিচাপে ব্যৱহাৰ কৰা হয়।
উত্তৰঃ T
15. 15, 16 আৰু 17ত শুদ্ধ বাচনিৰ বিপৰীতে (3) চিন আৰু ভুল বাচনিৰ বিপৰীতে (x) চিন দিয়া।
ৰাডাৰ ফ’ৰ্ডৰ আলফা কণা বিচ্ছুৰণ পৰীক্ষাই –
(a) পাৰমাণৱিক নিউক্লিয়াছ।
(b) ইলেকট্রন।
(c) প্রটন।
(d) নিউট্রন আবিস্কাৰ কৰিছিল।
উত্তৰঃ
| (a) পাৰমাণৱিক নিউক্সিয়াছ | (3) |
| (b) ইলেকট্রন | (x) |
| (c) প্রটন | (x) |
| (d) নিউট্রন | (x) |
16. মৌল এটাৰ সমস্থানিকবোৰৰ-
(a) একে ভৌতিক ধর্ম।
(b) ভিন্ন ৰাসায়নিক ধর্ম।
(c) ভিন্ন সংখ্যক নিউট্রন।
(d) ভিন্ন পারমাণবিক সংখ্যা থাকে।
উত্তৰঃ
| (a) একে ভৌতিক ধর্ম | (3) |
| (b) ভিন্ন ৰাসায়নিক ধর্ম | (x) |
| (c) ভিন্ন সংখ্যক নিউট্রন | (3) |
| (d) ভিন্ন পাৰমাণৱিক সংখ্যা | (x) |
17. CI- আয়নত যোজ্যতা ইলেকট্রনৰ সংখ্যা
(a) 16
(b) 8
(c) 17
(d) 18
উত্তৰঃ
| (a) 16 | (x) |
| (b) 8 | (3) |
| (c) 17 | (x) |
| (d) 18 | (x) |
18. তলৰ কোনটো ছ’ডিয়ামৰ শুদ্ধ ইলেকট্রনীয় বিন্যাস?
(a) 2,8
(b) 8, 2, 1
(c) 2, 1, 8
(d) 2, 8, 1
উত্তৰঃ (d) 2, 8, 1
19. তলৰ তালিকাখন সম্পূৰ্ণ কৰা।
| পামাণৱিক সংখ্যা | ভৰ সংখ্যা | নিউট্রনৰ সংখ্য | প্ৰটনৰ সংখ্য | ইলেকট্রনৰ সংখ্যা | পৰমাণু/আয়নৰসংখ্যা |
| 9 | – | 10 | – | – | – |
| 16 | 32 | – | – | – | ছালফাৰ |
| – | 24 | – | 12 | – | – |
| – | 2 | – | 1 | – | – |
| – | 1 | 0 | 1 | 0 | – |
উত্তৰঃ
| পাৰমাণৱিকসংখ্যা | ভৰ সংখ্যা | নিউট্রনৰ সংখ্যা | প্ৰটনৰ সংখ্যা | ইলেকট্রনৰ সংখ্যা | পৰমাণু /আয়নৰ নাম |
| 9 | 19 | 10 | 9 | 9 | ফুৰিণ |
| 16 | 32 | 16 | 16 | 16 | ছালফাৰ |
| 12 | 24 | 12 | 12 | 12 | মেগনেছিয়াম |
| 1 | 2 | 1 | 1 | 1 | ডিউটেৰিয়াম |
| 1 | 1 | 0 | 1 | 0 | হাইড্রজেন |
অতিৰিক্ত প্রশ্নোত্তৰঃ
1. পৰমাণুত থকা মৌলিক কণিকা কেইটাৰ নাম লিখা। এই কণিকা কেইটাৰ ভৰ আৰু আধানৰ মান SI এককত লিখা।
উত্তৰঃ পৰমাণুত থকা মৌলিক কণিকা কেইটা হৈছে ইলেকট্রন, প্ৰটন আৰু নিউট্রন।
ইলেকট্ৰনত থকা আধানৰ পৰিমাণ = -1.602×10⁻¹⁹ কুলম্ব
ইলেকট্রনৰ ভৰ = 9.109 × 10⁻³¹ কি.গ্রা.
প্ৰটনত থকা আধানৰ পৰিমাণ = 1.602 × 10⁻¹⁹ কুলম্ব
প্রটনৰ ভৰ = 1.625×10⁻²⁷ কি.গ্রা.
নিউট্ৰনত থকা আধানৰ পৰিমাণ = 0
নিউট্রনৰ ভৰ = 1.675 × 10⁻²⁷কি.গ্রা.
2. α -ৰশ্মি বিচ্চুৰণ পৰীক্ষাটো কোনে কৰিছিল? এই পৰীক্ষাটোত দুটা পৰ্য্যাবেক্ষণ লিখা।
উত্তৰঃ ৰাডাৰফ’ৰ্ডে
এই পৰীক্ষাটোৰ দুটা পৰ্য্যাবেক্ষণ :—
(i) বেছি ভাগ α – কণিকা সোণৰ পাতখনৰ মাজেদি ওলাই যায়।
(ii)পাতখনৰ মাজেদি সৰকি যাওঁতে খুউব কম সংখ্যক a-কণিকাৰ পথৰ দিশ সলনি হয়। এই কম সংখ্যকৰ প্ৰায় 1000 টা কণিকাৰ এটা কণিকাৰ বিচ্যুতি 180° পৰ্য্যস্ত হয় অর্থাৎ সোণৰ পাতচলাত খুন্দা খাই অহা পথত উভতি যায়।
3. ৰাডাৰফৰ্ডৰ পৰমাণুৰ আৰ্হিটো ব্যাখ্যা কৰা। এই আৰ্হিৰ আসোঁৱাহ উল্লেখ কৰা।
উত্তৰঃ ৰাডাৰ ফৰ্ডৰ পৰমাণুৰ আৰ্হিঃ
ৰাডাৰফৰ্ডে তেওঁ কৰা পৰীক্ষাৰ পৰ্য্যাবেক্ষণবোৰৰ ব্যাখ্যা দাঙি ধৰি পৰমাণুৰ এটা আৰ্হি দিয়ে। তেওঁৰ আৰ্হিটোক নিউক্লিয় আৰ্হি বুলিও কোৱা হয়।
ৰাডাৰফৰ্ডৰ মতে পৰমাণুত দুটা অংশ থাকে — 1. নিউক্লিয় অংশ আৰু 2. বহিঃ নিউক্লিয় অংশ।
পৰমাণু টোৰ বেছি ভাগ ঠাই খালি আৰু নিউক্লিয়াছটোত পৰমাণুটোৰ গোটেই ভৰখিনি থুপ খাই থাকে। নিউক্লিয়াছটোৰ চাৰিওফালে কিছুমান বৃত্তাকাৰ পথত ঋণাত্মক আধানযুক্ত ইলেকট্রনবোৰ ঘুৰি থাকে। ইলেকট্রনৰ সংখ্যা নিউক্লিয়াছত থকা মুঠ আধানৰ সংখ্যাৰ সমান। নিউক্লিয়াছ আৰু ইলেকট্রনৰ মাজৰ কুলম্বীয় আকৰ্ষণ আৰু ইলেকট্রনবোৰে বৃত্তাকাৰ পথত ঘূৰি থাকোতে আৱশ্যকীয় অপকেন্দ্রীক বল এই দুয়োটা সাম্যবস্থাত থাকে।
ৰাডাৰফৰ্ডৰ পৰমাণুৰ আৰ্হিৰ আসোঁৱাহ :
ৰাডাৰফৰ্ড পৰমাণুৰ আৰ্হিটো সুস্থিৰ হ’ব নোৱাৰে বুলি বৰে দেখুৱাইছিল। বিকিৰণৰ বিদ্যুত চুম্বকীয় সূত্র অনুসৰি আধান যুক্ত বস্তু এটা বৃত্তাকাৰ পথত ঘুৰি থাকিলে ই অবিচ্ছিন্নভাৱে শক্তি বিকিৰণ কৰিব। ৰাডাৰফৰ্ডৰ আৰ্হিত ইলেকট্রনবোৰ বৃত্তাকাৰ কক্ষপথত নিউক্লিয়াছৰ চাৰিওফালে ঘূৰি থাকে। যিহেতু ইলেকট্রনটো ঋণাত্মক আধানযুক্ত, গতিকে বৃত্তাকাৰ পথত ঘূৰি থাকোতে ইলেকট্রনটোৱে অবিচ্ছিন্নভাৱে শক্তি বিকিৰণ কৰি থাকিব। ফলস্বৰূপে ইলেকট্রনটোৱে ক্রমান্বয়ে শক্তি হেৰুৱাই কুণ্ডলীৰ দৰে পথেৰে আহি নিউক্লিয়াছত পৰিবহি। অর্থাৎ ৰাডাৰফৰ্ডৰ পৰমাণুটো সুস্থিৰ হ’ব নোৱাৰে।
4. ব’ৰৰ পাৰমাণৱিক আৰ্হিৰ প্ৰকল্প কেইটা লিখা।
উত্তৰঃ (i) পৰমাণু এটাৰ ইলেকট্রনবোৰে নিউক্লিয়াছটোৰ চাৰিওফালে থকা কিছুমান নিৰ্দিষ্ট বৃত্তাকাৰ কক্ষপথত ঘূৰি থাকে।এই কক্ষপথবোৰক স্থিৰ কক্ষপথ বা শক্তিক্তৰ বোলে।
(ii) প্ৰতিটো শক্তিস্তৰত নিহিত থকা শক্তিৰ পৰিমাণ নিৰ্দিষ্ট। শক্তিক্তৰবোৰক K, L, M, N -–—- বা 1, 2, 3, 4 —- সংখ্যাৰ দ্বাৰা বুজোৱা হয়।
(iii) নিৰ্দিষ্ট কক্ষপথ এটাত ঘূৰি থাকোতে ইলেকট্রন এটাত নিৰ্দিষ্ট পৰিমাণৰ শক্তি নিহিত হৈ থাকে। গতিকে স্থিৰ কক্ষপথ এটাত ঘূৰি থকা অৱস্থাত ইলেকট্রন এটাই শক্তিৰ অৱশোষণ বা বিকিৰণ নকৰে।
(iv) এটা কক্ষপথৰ পৰা অন্য এটা কফপথলৈ ইলেকট্রন এটাই জপিয়ালে নিৰ্দিষ্ট পৰিমাণৰ শক্তি অৱশোষণ বা বিকিৰণ কৰিব। তলৰ কক্ষপথৰ পৰা ওপৰৰ কক্ষপথলৈ গ’লে ইলেকট্রনে শক্তি অবশোষণ কৰিব আৰু ওপৰৰ কক্ষপথৰ পৰা তলৰ কক্ষপথলৈ জপিয়ালে ইলেকট্রনে শক্তি বিকিৰণ কৰিব।
5. তলত দিয়া মৌলসমূহৰ ইলেকট্রনীয় বিন্যাস লিখা
He, B, C, O, Cl, Na, Al, Ca, K, S, P
উত্তৰঃ
| মৌল | ইলেকট্রনীয় বিন্যাস He |
| He | 2 |
| B | 2,3 |
| C | 2,4 |
| O | 2,6 |
| Cl | 2,8,7 |
| Na | 2,8,1 |
| Al | 2,8,3 |
| Ca | 2,8,8,2 |
| K | 2,8,81 |
| S | 2,8,6 |
| P | 2,8,5 |
6. অষ্টক নিয়মটো কি এই নিয়মৰ সহায়ত মৌল এটাৰ যোজ্যতা কিদৰে নিৰূপণ কৰিবা এটা উদাহৰণ সহ ব্যাখ্যা কৰা।
উত্তৰঃ অষ্টকনিময় : ৰাসায়নিক মিলনৰ সময়ত মৌলৰ পৰমাণুবোৰে ইহঁতৰ যোজক কক্ষ আঠটা ইলেকট্রনেৰে পূৰ্ণ কৰিব বিচাৰে। ইয়াৰদ্বাৰা পৰমাণু এটাইপৰ্য্যাবৃত্ততালিকাত থকা ইয়াৰ ওচৰৰ সম্ভ্ৰান্ত গেছটোৰ সুস্থিৰ ইলেকট্ৰনীয় সজ্জা লাভ কৰে।
অষ্টক নিয়মৰ সহায়ত মৌল এটাৰ যোজ্যতা নির্ণয় কৰিব পাৰি। উদাহৰণ স্বৰূপে হিলিয়ামৰ বাহিৰে সম্ভ্ৰান্ত মৌলৰ পৰমাণুৰ বহিঃকক্ষটো আঠটা ইলেকট্রনেৰে পৰিপূৰ্ণ হৈ থাকে। সেয়ে, সম্ভ্রান্ত গেছসমূহে তাৰ বহিঃকক্ষত ইলেকট্রন গ্ৰহণ কৰা বা সেই কক্ষৰ পৰা ইলেকট্রন এৰি দিয়াৰ প্ৰবণতা নাথাকে। অর্থাৎ মৌলবোৰৰ যোজ্যতা শূণ্য, হিলিয়ামৰ পৰমাণুত এটা শক্তিস্তৰ আছে আৰু এই স্তৰত দুটা ইলেকট্রন থাকে বাবে হিলিয়ামৰ যোজ্যতাও শূণ্য হয়। .
7. ছডিয়াম আয়ন আৰু ক্লৰাইড আয়নৰ ইলেকট্ৰনীয় বিন্যাস কেইটা লিখা। ছডিয়াম ক্লাইডৰ সংকেত কি হ’ব অষ্টক নিয়ম অনুসৰি লিখা।
উত্তৰঃ Naৰ পৰমাণু ক্রমাংক = 11
∴ Na⁺ৰ ইলেকট্রনীয় বিন্যাস = 2,8
Cl ৰ পৰমাণু ক্ৰংমাক = 17
∴ CIৰ ইলেকট্রনীয় বিন্যাস = 2, 8, 8 Na য়ে এটা ইলেকট্রন ত্যাগ কৰি Na⁺ আয়ন হয় আৰু ইয়াৰ ওচৰৰ সম্ভ্ৰান্ত গেছ Neৰ ইলেকট্রনীয় বিন্যাস লাভ কৰে। Na – e⁻ → Na⁺
2.8.1. 2.8 (নিয়ণৰ সজ্জা)
CIয়ে এটা ইলেকট্রন গ্রহণ কৰি CI-আয়ন হয় আৰু ইয়াৰ ওচৰৰ সম্ভ্রান্ত গেছ Arৰ ইলেকট্রনীয় বিন্যাস লাভ কৰে।
Cl + e⁻ → Cr⁻
2.8.7 2.8.8 (আগনৰ সজ্জা)
CIয়ে এটা ইলেকট্রন গ্ৰহণ কৰি CI-আয়ন হয় আৰু ইয়াৰ ওচৰৰ সম্ভ্ৰান্ত গেছ Arৰ ইলেকট্রনীয় বিন্যাস লাভ কৰে।
Cl + e ⁻→ Cl⁻
2.8.7 2,8,8(আর্গনৰ সজ্জা)
এতিয়া ৰাসায়নিক বিক্রিয়াত Nacয় ত্যাগ কৰা ইলেকট্রনটো CIয়ে গ্রহণ কৰে। ফলত Na⁺ আয়ন আৰু Cl⁻আয়নৰ সৃষ্টি হয় আৰু বিক্ৰিয়াৰ ফলত Na⁺Cl⁻ সৃষ্টি হয়।
গতিকে ছডিয়াম ক্লৰাইডৰ সংকেত হ’ব NaCl
8. কাৰণ দৰ্শোৱাঃ
(a) ¹₁H, ²₁H আৰু ³₁ H নিউক্লাইড কেইটা বৈদ্যুতিকভাৱে প্ৰশম আৰু ৰাসায়নিক ধর্ম একে।
(b) Na পৰমাণুতকৈ Na আয়ন বেছি সুস্থিৰ।
(c) অক্সিজেনৰ যোজ্যতা সদায় দুই।
উত্তৰঃ (a) ¹₁H, 2/1H আৰু ³₁H নিউক্লাইড কেইটাৰ প্ৰত্যেকতে প্ৰটনৰ সংখ্যা 1। সেইবাবে ইহঁত বৈদ্যুতিকভাৱে প্ৰশম আৰু ৰাসায়নিক ধৰ্ম একে।
(b) Na পৰমাণুত থকা প্ৰটনৰ সংখ্যা 11। গতিকে Naৰ ইলেকট্রনীয় সজ্জা সুস্থিৰ নহয়। আনহাতে Na⁺আয়নৰ ইলেকট্ৰনীয় সজ্জা সম্ভ্রান্ত গেছ Neৰ ইলেকট্ৰনীয় সজ্জাৰ সৈতে একে। গতিকে Na⁺আয়ন সুস্থিৰ।
(c) অক্সিজেনৰ পৰমাণু ক্ৰমাংক ৪। গতিকে অক্সিজেনৰ ইলেকট্ৰনীয় বিন্যাস হ’ব 2,6 ।
এতেকে অক্সিজেনৰ যোজ্যতা = 8-6 = 2
9. তলত দিয়া যোৰ বোৰৰ পৰা সমস্থানিক বাছি উলিওৱাঃ
(a) ⁷⁴₃₃x, ⁷⁵₃₃x
(b) ⁵⁵₂₅x, ⁵⁵₂₆x
উত্তৰ: (a)⁷⁴₃₃x, ⁷⁵₃₃x
10. তলত দিয়া যোৰ বোৰৰ পৰা সমভাৰীবোৰ বাছি উলিওৱাঃ
(a) ⁴⁰₁₉×, ³⁹₁₉x
(b) ⁴⁰₁₉× , ⁴⁰₂₀×
উত্তৰঃ (b) ⁴⁰₁₉× , ⁴⁰₂₀×
11. এটা মৌলৰ পাৰমাণবিক সংখ্যা 16 আৰু ভৰ সংখ্যা 34। মৌলটোত কিমানটা ইলেকট্রন, প্রটন আৰু নিউট্রন আছে? মৌলটোৰ ইলেকট্রনীয় বিন্যাসটো লিখা। মৌলটোৰ যোজ্যতা কি হ’ব?
উত্তৰঃ মৌলটোৰ পাৰমাণৱিক সংখ্যা = 16
মৌলটোৰ পাৰমাণৱিক সংখ্যা = 34
∴ ইলেকট্রনৰ সংখ্যা = 16
প্রটনৰ সংখ্যা = 16
নিউট্রনৰ সংখ্যা = 34 – 16 =18
মৌলটোৰ ইলেকট্রনীয় বিন্যাস = 2, 8, 6
মৌলটো যোজ্যতা = 8-6
= 2
12. তলত দিয়া প্ৰশ্নবোৰৰ প্ৰতিটোৰ চাৰিটাকৈ উত্তৰ দিয়া আছে। শুদ্ধ উত্তৰটো বাছিউলিওৱা
(i) কেথ’ড ৰশ্মিত থকা কণিকাটোৰ নাম –
(a) ইলেকট্রন।
(b) প্রটন।
(c) নিউট্রন।
(d) নিউক্লিয়াছ।
উত্তৰঃ (a) ইলেকট্রন।
(ii) ৰাডাৰফৰ্ডৰ কণিকা বিচ্যুতিৰ পৰীক্ষাত তলত দিয়া কোনটো কণিকা আবিষ্কাৰ হয়?
(a) ইলেকট্রন।
(b) প্রটন।
(c) নিউট্রন।
(d) নিউক্লিয়াছ।
উত্তৰঃ (d) নিউক্লিয়াছ।
(iii) A/Z x মৌলটোত থকা প্ৰটন, নিউট্রন আৰু ইলেকট্রনৰ সংখ্যা হৈছে
(a) A, Z, Z
(b) Z, A, (A – Z)
(c) Z, (A – Z), Z
(d) (A – Z), Z, Z
উত্তৰঃ (c) Z, (A – Z), Z
(iv) সমস্থানিক হৈছে –
(a) একে ভৰসংখ্যাৰ বিভিন্ন মৌলৰ নিউক্লাইড।
(b) বিভিন্ন মৌলৰ বিভিন্ন ভৰ সংখ্যাৰ নিউক্লাইড।
(c) একেটা মৌলৰ বিভিন্ন ভৰ সংখ্যাৰ নিউক্লাইড।
(d) এইবোৰৰ এটাও নহয়।
উত্তৰঃ (b) বিভিন্ন মৌলৰ বিভিন্ন ভৰ সংখ্যাৰ নিউক্লাইড।
(v) ইলেকট্রনত থকা আধানৰ মান –
(a) – 4.803x 10⁻¹⁹ কুলম্ব।
(b) – 1.602 × 10⁻¹⁹ ই. এছ. ইউ।
(c) – 4.803×10⁻¹⁹ ই. এছ. ইউ।
(d) – 1.602×10⁻¹⁹ কুলম্ব।
উত্তৰঃ (d) – 1.602 x 10⁻¹⁹ কুলম্ব।
(vi) পাৰমাণৱিক ভৰ এককত প্লটন এটাৰ প্ৰকৃত ভৰ হৈছে –
(a) 5.48 x 10⁻⁴ u
(b) 1.00728 u
(c) 1.00866 u
(d) 1.6725 u
উত্তৰঃ (b) 1.00728u
(vii) এটা মাত্র সমস্থানিকৰ প্ৰকৃতিত পোৱা মৌল এটা হৈছে
(a) অক্সিজেন।
(b) নাইট্রজেন।
(c) নিয়ন।
(d) ফ্লৰিণ।
উত্তৰঃ (d) ফ্লৰিণ।
(viii) অক্সাইড আয়ন, O²⁻ ত থকা যোজক ইলেকট্রনৰ সংখ্যা –
(a) 2
(b) 6
(c) 0
(d) 8
উত্তৰঃ (d) 8
13. তলত দিয়া উক্তিবোৰ ভুল নে শুদ্ধ বাছি উলিওৱা, ভুল উক্তিবোৰ শুধৰাই লবা।
(i) কেথ’ড ৰশ্মিবোৰ ধণাত্মক আধানযুক্ত কণিকাৰে গঠিত।
উত্তৰঃ ভুল। কেথড় ৰশ্মিবোৰ ঋণাত্মক আধানযুক্ত কণিকাৰে গঠিত।
(ii) পাৰমাণবিক সংখ্যা নিউক্লিয়নৰ সংখ্যাৰ সমান।
উত্তৰঃ ভুল৷ পাৰমাণৱিক সংখ্যা প্ৰটনৰ সংখ্যা আৰু নিউক্লিয়ণৰ সংখ্যা প্ৰটন আৰু নিউট্ৰনৰ মুঠ সংখ্যাৰ সমান।
(iii) পাৰমাণৱিক ভৰ সংখ্যা নিউক্লিয়াছত থকা প্ৰটন আৰু নিউট্ৰনৰ মুঠ ভৰৰ সমান।
উত্তৰঃ শুদ্ধ।
(iv) সমভাৰীবোৰত সমান সংখ্যক নিউট্রন থাকে।
উত্তৰঃ ভুল। সমভাৰীবোৰত সমান সংখ্যক ভৰ সংখ্যা থাকে।
(v) ব’ৰ বেৰী আঁচনি মতে পৰমাণুৰ শেষৰ আগৰ কক্ষত 2n2 সংখ্যক ইলেকট্রন থাকে য’ত n হৈছে সেই শক্তিস্তৰৰ সংখ্যা।
উত্তৰঃ ভুল। পৰমাণুৰ সকলো কক্ষত 2n2 সংখ্যক ইলেকট্রন থাকে।
(vi) পৰমাণু এটাৰ ব্যাসার্ধ প্রায় 10°চে.মি. হয়।
উত্তৰঃ (vi) শুদ্ধ
(vii) ⁶⁰₂₇ Co সমস্থানিকটো থাইৰয়ড ৰেমাৰত ঔষধ হিচাপে ব্যৱহাৰ হয়।
উত্তৰঃ ভুল। ⁶⁰₂₇ Co সমস্থানিকটো কৰ্কট ৰোগৰ চিকিৎসাত ব্যৱহাৰ কৰা হয়।
14. খালী ঠাই পূৰণ কৰা :
(i) কেথ’ড ৰশ্মিবোৰ —– আধানযুক্ত কণিকাৰ দ্বাৰা গঠিত।
উত্তৰঃ ঋণাত্মক।
(ii) প্ৰটনৰ ভৰ —- কি.গ্রা. আৰু ইয়াৰ আধানৰ মান —–– কুলম্ব।
উত্তৰঃ 1.6725×10⁻²⁷, +1.602×10⁻¹⁹
(iii) নিউট্রন বৈদুতিকভাৱে –— আৰু ইয়াৰ ভৰ প্ৰটনৰৰ ভৰৰ
উত্তৰঃ আধানহীন, প্রায় সমান।
(iv) পৰমাণুত থকা আধানযুক্ত মৌলিক কণিকাকেইটা হৈছে —— আৰু —– ।
উত্তৰঃ ইলেকট্রন, প্রটন।
(v) সমস্থানিকবোৰত সমান সংখ্যাক —— আৰু বিভিন্ন সংখ্যক —– থাকে ।
উত্তৰঃ প্রটন, নিউট্রন।
(vi) সমভাৰীবোৰৰ ভৰ সংখ্যা —– কিন্তু প্ৰটনৰ সংখ্যা —– ।
উত্তৰঃ সমান, বেলেগ।
(vii) মৌল এটাৰ পাৰমাণবিক সংখ্যা 12 আৰু ভৰ সংখ্যা 24। গতিকে মৌলটোত —–– ইলেকট্রন আৰু –— টা নিউট্রন থাকিব।
উত্তৰঃ 12, 12
(viii) ছডিয়ামৰ ইলেকট্রনীয় বিন্যাস —— —–আৰু ইয়াৰ যোজ্যতা।
উত্তৰঃ 2, 8, 1; 1
15. ইলেকট্রন, প্রটন আৰু নিউট্রন আৱিষ্কাৰ কৰা বিজ্ঞানী কেইজনমানৰ নাম লিখা।
উত্তৰঃ
| ইলেকট্রন | J. J. Thomson |
| প্লটন | E.Rutherford |
| নিউট্রন | Sir Jame Chadwick |
16. কেথড ৰশ্মি কি ?
উত্তৰঃ বিদ্যুত মোক্ষা নলী এটাত অতি কম চাপত বিদ্যুৎ পৰিবাহিত কৰিলে কেথডৰ পৰা এনডলৈ সেউজ নীলা ৰঙৰ কিছুমান ৰশ্মি সৰল ৰেখাত গতি কৰে। এই ৰশ্মিবোৰক কেথড ৰশ্মি বুলি কোৱা হয়।
17. এনড ৰশ্মি কাক বোলে?
উত্তৰঃ বিদ্যুৎ মোক্ষন নলীত ব্যৱহাৰ কৰা কেথডডাল সৰু সৰু ৰন্ধ্ৰ বিশিষ্ট হ’লে কেথড ৰশ্মিৰ বিপৰীত দিশে সৰল ৰেখাত গতি কৰা কিছুমান ৰশ্মি দেখা যায়। এই ৰশ্মিবোৰ নলীটোৰ ভিতৰত থকা গেছৰ ঋণাত্মক। আধান বিশিষ্ট অণু বা পৰমাণুৰ দ্বাৰা গঠিত। এই ৰশ্মিবোৰক এনড ৰশ্মি বোলে।
18. মৌলৰ পৰমাণু কিয় বৈদ্যুতিকভাৱে উদাসীন?
উত্তৰঃ যিহেতু পৰমাণু এটাত প্ৰটন আৰু ইলেকট্রনৰ সংখ্যা সমান গতিকে মৌলৰ পৰমাণু বিদ্যুতিকভাৱে উদাসীন।
19. ৰাসায়নিক বিক্ৰিয়াত মৌলৰ পৰামাণৱিক সংখ্যা কিয় অপৰিবৰ্তিত থাকে?
উত্তৰঃ ৰাসায়নিক বিক্ৰিয়াত মৌলৰ ইলেকট্রনেহে অংশ গ্ৰহণ কৰে। গতিকে বিক্ৰিয়া এটাত মৌলৰ প্ৰটুনৰ সংখ্যাৰ পৰিবৰ্তন নহয়।
20. ছ’ডিয়ামৰ পৰা কেলছিয়ামলৈকে মৌলবোৰৰ পাৰমাণৱিক সংখ্যা, নিউট্ৰনৰ সংখ্যা আৰু ভৰ সংখ্যাৰ এখন তালিকা প্রস্তুত কৰা।
উত্তৰঃ
| মৌল | পাৰমাণৱিকসংখ্যা (Z) | নিউট্রনৰসংখ্যা (N) | ভৰ সংখ্যা(A) |
| ছডিয়াম | 11 | 12 | 23 |
| মেগনেছিয়াম | 12 | 12 | 24 |
| এলুমিনিয়াম | 13 | 14 | 27 |
| ছিলিকন | 14 | 14 | 28 |
| ফছফৰাচ | 15 | 17 | 32 |
| ছালফাৰ | 16 | 16 | 32 |
| ক্লৰিণ | 17 | 18 | 35 |
| আর্গন | 18 | 22 | 40 |
| পটেছিয়াম | 19 | 20 | 39 |
| কেলছিয়াম | 20 | 20 | 40 |
21. ক্লৰিণ পৰমাণুৰ যোজ্যতা কক্ষত থকা ইলেকট্ৰনৰ সংখ্যা কিমান?
উত্তৰঃ ক্লৰিণ পৰমাণুৰ ইলেকট্রনীয় বিন্যাস = 2, 8, 7
∴ যোজ্যতা কক্ষত থকা ইলেকট্রনৰ সংখ্যা = 7
22. এটা পৰমাণু ‘X’ৰ ভৰ সংখ্যা 4 আৰু পাৰমাণৱিক সংখ্যা 2। ইয়াৰ যোজ্যতা কিমান?
উত্তৰঃ শূণ্য।
23. 35 cl আৰু 38clৰ যোজ্যতা একেনে? ব্যাখ্যা কৰা।
উত্তৰঃ ³⁵₁₇ CI আৰু ³⁷₁₇Cl দুটা সমস্থানিক। ইহঁতৰ ইলেকট্রনৰ সংখ্যা সমান। গতিকে ইহঁতৰ ইলেকট্রনীয় সজ্জাও একে। এতেকে ইহঁতৰ যোজ্যতা সমান।
24. ৰাডাৰফৰ্ডে a – ৰশ্মি বিচ্ছুৰণ পৰীক্ষাৰ সোণৰ পাতবাচি লোৱাৰ কাৰণ কি?
উত্তৰঃ কাৰণ তেওঁ যিমান সম্ভব সিমান পাতল স্তৰ এটা বিচাৰিছিল।
25. তলত দিয়া চিত্ৰ দুটাৰ পৰা পৰমাণুৰ যোজ্যতা নির্ণয় কৰা।
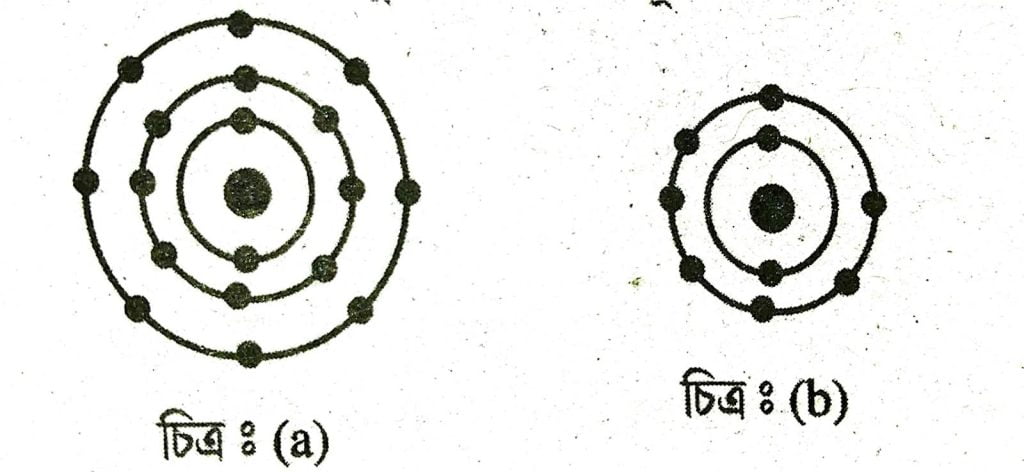
উত্তৰঃ (a) 0
(b) 1
26. কে’থড ৰশ্মিৰ উৎপত্তিৰ এটা চিহ্নিত চিত্র আঁকা।
উত্তৰঃ
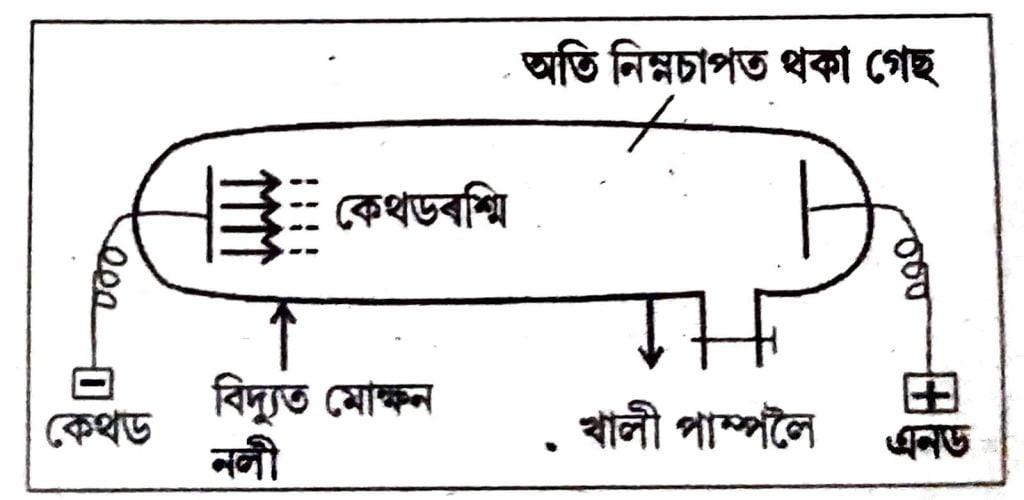
চিত্র : কেথড ৰশ্মিৰ উৎপত্তি
27. হাইড্ৰজেনৰ সমস্থানিককেইটাৰ নাম লিখা আৰু ইহঁতৰ গঠন কেনেকুৱা লিখা ।
উত্তৰঃ হাইড্ৰজেনৰ সমস্থানিককেইটা হৈছে —
(a) প্রটিয়াম ( 1/1 H)
(b) ডয়টেৰিয়াম ( 2/1 H)
(c) ব্রিটিয়াম (3/1H)
ইহঁতৰ পাৰমাণৱিক গঠনঃ

28. ৰাডাৰফৰ্ডৰ নিউক্লীয় আৰ্হিৰ বৈশিষ্ট্যবোৰ কি আছিল?
উত্তৰঃ (i) পৰমাণুত ধণাত্মক আধানযুক্ত এটা কেন্দ্র থাকে। ইয়াক নিউক্লিয়াছ বোলে । পৰমাণু এটাৰ প্ৰায় সকলোখিনি ভৰ নিউক্লিয়াছটোতেই থুপ খাই থাকে।
(ii) নিউক্লিয়াছটোৰ চাৰিওফালে কিছুমান সুনির্দিষ্ট কক্ষপথত ইলেকট্রনবোৰ ঘূৰি থাকে।
(iii) পৰমাণুৰ আকাৰৰ তুলনাত নিউক্লিয়াছৰ আকাৰ নিচেই সৰু।
29. ব’ৰৰ পৰমাণুৰ আৰ্হিৰ দুটা স্বীকাৰ্য্য লিখা।
উত্তৰঃ (i) পৰমাণুৰ ভিতৰত ইলেকট্ৰনৰ কিছুমান নির্দিষ্ট অনুমোদিত কক্ষপথ হে থাকে।
(ii) এই কক্ষপথবোৰত ঘূৰি থাকোতে ইলেকট্রনে শক্তি বিকিৰণ নকৰে।
30. তলত দিয়া মৌলবোৰৰ পৰা সমস্থানিক আৰু সমভাৰীবোৰ বাছি উলিয়াই ভৰ সংখ্যা, প্ৰটন সংখ্যা, ইলেকট্রন সংখ্যা আৰু নিউট্রন সংখ্যাৰ এখন তালিকা প্রস্তুত কৰা।

| মৌলৰ নাম | পাৰমাণৱিক সংখ্যা | ভৰ সংখ্যা | প্ৰটন সংখ্যা | নিউট্রন সংখ্যা | ইলেকট্রনৰ সংখ্যা |
| হাইড্ৰ’জেন | 1 | 1 | 1 | 0 | 1 |
| হিলিয়াম | 2 | 3 | 2 | 1 | 2 |
| ফছফৰাচ | 15 | 32 | 15 | 17 | 15 |
| নাইট্রজেন | 7 | 15 | 7 | 8 | 7 |
| কার্বন | 6 | 14 | 6 | 8 | 6 |
| আর্গন | 18 | 40 | 18 | 22 | 18 |
| ছালফাৰ | 16 | 32 | 16 | 16 | 16 |
| পটেছিয়াম | 19 | 40 | 19 | 21 | 19 |
| কেলছিয়াম | 20 | 40 | 20 | 20 | 20 |
31. কৰ্কট ৰোগৰ চিকিৎসাত ব্যৱহাৰ কৰা সমস্থানিক কেইটা কি কি?
উত্তৰঃ ⁶⁰₂₇Co , ²²⁵₈₈ Ra আৰু ¹⁹⁸₇₉ Au
32. মৃত জীৱৰ বসয় গণনাত ব্যৱহাৰ হোৱা সমস্থানিকটোৰ নাম কি ?
উত্তৰঃ তেজস্ক্রিয় কার্বন (¹⁴₆c)।
33. আইচ’বাৰ শব্দটো কোনে নামাকৰণ কৰিছিল
উত্তৰঃ A. W. Stewart.
34. সমভাৰীবোৰৰ ৰাসায়নিক আৰু ভৌতিক ধৰ্মবোৰ কিয় বেলেগ হয়?
উত্তৰঃ সমভাৰীবোৰত প্ৰটন আৰু নিউট্ৰনৰ সংখ্যা বেলেগ বেলেগ হয়। সেই কাৰণে ইহঁতৰ ৰাসায়নিক আৰু ভৌতিক ধৰ্মবোৰ বেলেগ হয়।
35. পৰমাণুৰ ইলেকট্রনীয় বিন্যাস বুলিলে কি বুজা?
উত্তৰঃ পৰমাণু এটাত নিউক্লিয়াছটোৰ চাৰিওফালে কিছুমান নির্দিষ্ট বৃত্তাকাৰ কক্ষপথত ইলেকট্রনবোৰ ঘূৰি থাকে। এই কক্ষপথ বা শক্তিস্তৰবোৰত প্ৰতিটোতে এক নির্দিষ্ট সংখ্যক ইলেকট্রন থাকিব পাৰে। পৰমাণু এটাৰ শক্তি স্তৰবোৰত ইলেকট্রনবোৰ থকাৰ সজ্জাক পৰমাণুটোৰ ইলেকট্রনীয় বিন্যাস বোলে।
36. বৰ-বেৰী আচনি কি? এই আচনিখনৰ নিয়মবোৰ লিখা।
উত্তৰঃ পৰমাণু এটাৰ বিভিন্ন শক্তিস্তৰত ইয়াৰ ইলেকট্রনবোৰ কি ধৰণেৰে সজ্জিত হৈ থাকে সেই বিষয়ে 1921 চনত বৰ আৰু বেৰীয়ে এখন আচনি আগবঢ়ায়। এই আচনিখনক বৰ-বেৰী আচনি বুলি কোৱা হয়। এই আচনিখনৰ নিয়মবোৰ তলত দিয়া হ’ল।
(i)পৰমাণু এটাৰ কোনো এটা কক্ষত ইলেকট্রনৰ সৰ্বাধিক সংখ্যা হ’ব 2n²।
ইয়াত n হ’ল শক্তিস্তৰটোৰ সংখ্যা।
গতিকে —-
প্ৰথম শক্তিস্তৰত ইলেকট্ৰনৰ সৰ্বাধিক সংখ্যা
(n=1, K কক্ষ) = 2 ×1²= 2
দ্বিতীয় শক্তিস্তৰত ইলেকট্রনৰ সৰ্বাধিক সংখ্যা
(n = 2, L কক্ষ) = 2 ×2² = 8
তৃতীয় শক্তিস্তৰত ইলেকট্ৰনৰ সৰ্বাধিক সংখ্যা
( n = 3, M কক্ষ) = 2 ×3² = 18
চতুৰ্থ শক্তিস্তৰত ইলেকট্ৰনৰ সৰ্বাধিক সংখ্যা
( n = 4, N কক্ষ) = 2 × 4²= 32 ইত্যাদি।
(ii) পৰমাণু এটাৰ বহিতম কক্ষত ৪টাতকৈ আৰু শেষৰ আগৰ কক্ষত 18 টাতকৈ বেছি ইলেকট্রন থাকিব নোৱাৰে।
(iii) এটা কক্ষ পূৰ্ণ হোৱাৰ আগতে নতুন কক্ষ এটা ইলেকট্রনেৰে পূৰ্ণ হ’বলৈ আৰম্ভ হ’ব পাৰে।
37. পাঁচটা মৌল P, Q, R, S, Tৰ ইলেকট্রন, গ্লটন আৰু নিউট্রনৰ সংখ্যা তলত দিয়া হলঃ —
| মৌল | ইলেকট্রন | প্রটন | নিউট্রন |
| P | 4 | 3 | 4 |
| Q | 8 | 3 | 9 |
| R | 17 | 17 | 20 |
| S | 17 | 17 | 18 |
| T | 18 | 18 | 22 |
নিৰ্ণয় কৰাঃ
(i) এটা কেটায়ন।
(ii) এটা এনায়ন।
(iii) এটা সম্ভ্রান্ত গেছ।
(iv) এযোৰ সমস্থানিক।
উত্তৰঃ (i) কেটায়ন = Q
(ii) এনায়ন = P
(iii) এটা সম্ভ্রান্ত গেছ = T
(iv) এযোৰ সমস্থানিক = R আৰু S
38. তলৰ টেবুলখন সম্পূৰ্ণ কৰা।
| মৌল | চিহ্ন | পাৰমাণৱিক সংখ্যা | ইলেকট্রনীয় বিন্যাস |
| কার্বন | |||
| ছালফাৰ | |||
| অক্সিজেন |
উত্তৰ:
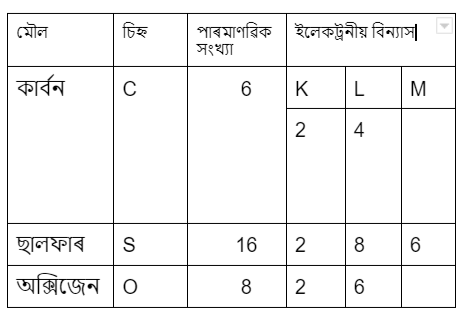
39. শুদ্ধ উত্তৰটো বাছি উলিওৱাঃ
(a) তলৰ কোনটো Mg পৰমাণুৰ ইলেকট্রনীয় বিন্যাস
(a) 8, 2, 2
(b) 2, 8, 2
(c) 3, 8, 1
(d) 1, 8, 3
উত্তৰঃ (b) 2, 8, 2
(b) মৌল এটাৰ বাবে তলৰ কোনবোৰ শুদ্ধ?
(i) পাৰমাণৱিক সংখ্যা = প্ৰটনৰ সংখ্যা + ইলেকট্ৰনৰ সংখ্যা
(ii) ভৰ সংখ্যা = প্ৰটনৰ সংখ্যা + নিউট্ৰনৰ সংখ্যা
(iii) পাৰমাণৱিক ভৰ = প্ৰটনৰ সংখ্যা = নিউট্রনৰ সংখ্যা
(iv) পাৰমাণৱিক সংখ্যা = প্ৰটনৰ সংখ্যা = ইলেকট্রনৰ
(A) (ii) আৰু (iii)
(B) (i) আৰু (ii)
(C) (i) আৰু (iii)
(D) (ii) আৰু (iv)
উত্তৰঃ (D) (ii) আৰু (iv)
(c) 1 যোজ্যতাৰ মৌলবোৰ হৈছে
(A) সদায় অধাতু।
(B) সদায় ধাতু।
(C) ধাতু বা অধাতু।
(D) এটাও নহয়।
উত্তৰঃ (C) ধাতু বা অধাতু।
(d) পৰমাণুৰ প্ৰথম আৰ্হি আবিষ্কাৰ কৰিছিল –
(A) E. Goldstein
(B) Rutherford
(C) N. Bohr
(D) J. J. Thomson
উত্তৰঃ (D) J. J. Thomson
(e) এটা মৌলৰ সমস্থানিকৰঃ
(A) বিভিন্ন ৰাসায়নিক ধর্ম।
(B) বিভিন্ন পাৰমাণবিক সংখ্যা।
(C) বিভিন্ন নিউট্রনৰ সংখ্যা।
(D) একে ভৌতিক ধর্ম।
উত্তৰঃ (C) বিভিন্ন নিউট্ৰনৰ সংখ্যা।
40. A অংশৰ লগত B অংশ মিলোৱা :
| A অংশ | B অংশ |
| (i) ¹⁴₆ C আৰু ¹³₆C | (a) পৰমাণু এটাত থকা প্ৰটন |
| (ii) Naৰ যোজ্যতা | (b) পৰমাণু এটাত প্ৰটন আৰু নিউট্রনৰ সংখ্যা |
| (iii) Co – 60 | (c) নিউট্রন |
| (iv) কাৰ্বনৰ পৰমাণুত থকা প্ৰটনৰ সংখ্যা | (d) সমস্থানিক |
| (v) ক্লৰিণৰ ইলেকট্রনীয় বিন্যাস | (e) 1 |
| (vi) হাইড্ৰজেনত নথকা | (f) কেন্সাৰৰ চিকিৎসা |
| (vii) পাৰমাণৱিক সংখ্যা | (g) 2,8,7 |
| (viii) ভৰ সংখ্যা | (h) 6 |
উত্তৰঃ (i) —— (d)
(ii) —— (e)
(iii) —— (f)
(iv) —— (h)
(v) —— (g)
(vi) —— (c)
(vii) —— (a)
(viii) —— (b)

Hi, I’m Dev Kirtonia, Founder & CEO of Dev Library. A website that provides all SCERT, NCERT 3 to 12, and BA, B.com, B.Sc, and Computer Science with Post Graduate Notes & Suggestions, Novel, eBooks, Biography, Quotes, Study Materials, and more.




Jid moilik akkok