Class 9 Science Chapter 3 পৰমাণু আৰু অণু, নৱম শ্ৰেণীৰ বিজ্ঞান প্ৰশ্নৰ উত্তৰ, Class 9 Science Question Answer to each chapter is provided in the list of SEBA বিজ্ঞান Class 9 Question Answer so that you can easily browse through different chapters and select needs one. Class 9 Science Chapter 3 পৰমাণু আৰু অণু Question Answer can be of great value to excel in the examination.
Class 9 Science Chapter 3 পৰমাণু আৰু অণু
SEBA Class 9 General Science Chapter 3 পৰমাণু আৰু অণু Notes cover all the exercise questions in Assam Board SEBA Textbooks. The SEBA Class 9 Science Chapter 3 পৰমাণু আৰু অণু provided here ensures a smooth and easy understanding of all the concepts. Understand the concepts behind every chapter and score well in the board exams.
পৰমাণু আৰু অণু
Chapter – 3
পাঠভিত্তিক ক্রিয়াকলাপৰ প্রশ্নোত্তৰ
1. বিক্রিয়া এটাত 5.3 গ্রাম ছডিয়াম কার্বনেট 6 গ্রাম ইথানয়িক এছিডৰ সৈতে বিক্ৰিয়া কৰিছিল। উৎপাদিত দ্রব্যবোৰ আছিল 2.2 গ্রাম কার্বন- ডাই-অক্সাইড, 0.9 গ্রাম পানী আৰু 8.2 গ্রাম ছ’ডিয়াম ইথানয়েট। দেখুওৱা যে ফলাফলবোৰ ভৰৰ নিত্যতা সূত্র অনুযায়ী হৈছে। ছডিয়াম কার্বনেট + ইথানয়িক এছিড → ছডিয়াম ইথানয়েট +
কার্বন-ডাই-অক্সাইড + পানী
উত্তৰঃ ছডিয়াম কার্বনেট + ইথানয়িক এচিড → ছডিয়াম ইথানয়েট + কার্বন-ডাই-অক্সাইড + পানী
ছডিয়াম কার্বনেটৰ ভৰ = 5.3 gm
ইথানয়িক এচিডৰ ভৰ = 6gm
বিক্ৰিয়ক পদাৰ্থৰ মুঠ ভৰ = (5.3 + 6) gm
= 11.3gm
ছডিয়াম ইথানয়েটৰ ভৰ = 8.2gm কার্বন-ডাই-অক্সাইডৰ ভৰ = 2.2gm
পানীৰ ভৰ = 0.9gm
উৎপাদিত দ্ৰৱ্যৰ মুঠ ভৰ = (8.2 + 2.2 + 0.9) gm
= 11.3gm
∴ বিক্ৰিয়ক পদাৰ্থৰ মুঠ ভৰ = উৎপাদিত দ্ৰব্যৰ মুঠ ভৰ।
যিহেতু বিক্ৰিয়ক পদাৰ্থৰ মুঠ ভৰৰ সৈতে উৎপাদিত দ্ৰব্যৰ মুঠ ভৰ সমান গতিকে ফলাফলবেৰে ভৰৰ নিত্যতা সূত্র মানি চলে।
2. হাইড্ৰজেন আৰু অক্সিজেন 1:8 ভৰৰ অনুপাতত লগ লাগি পানী উৎপন্ন কৰে। 3 গ্রাম হাইড্ৰজেনৰ সৈতে সম্পূৰ্ণকৈ বিক্ৰিয়া কৰিবলৈ কিমান ভৰৰ অক্সিজেন প্রয়োজন হ’ব?
উত্তৰঃ পানী উৎপন্ন কৰিবলৈ –
1 গ্রাম হাইড্ৰজেনৰ সৈতে বিক্রিয়া কৰা অক্সিজেনৰ পৰিমাণ = ৪ গ্রাম
∴ 3 গ্রাম হাইড্ৰজেনৰ সৈতে বিক্রিয়া কৰা অক্সিজেনৰ পৰিমাণ = 8 × 3 গ্রাম = 24 গ্রাম
3 . ডেল্টনৰ পৰমাণুবাদৰ কোনটো স্বীকাৰ্য্য ভৰৰ নিত্যতা সূত্ৰৰ ফল ?
উত্তৰঃ ডেল্টনৰ পৰমাণুবাদৰ মতে মৌলই হওঁক বা যৌগই হওঁক বা মিশ্র পদাৰ্থই হওঁক সকলোবোৰ পৰমাণু নামৰ ক্ষুদ্ৰ কণিকাৰে গঠিত। পৰমাণুবোৰ অবিভাজ্য কণা যাক ৰাসায়নিক বিক্রিয়া এটাত সৃষ্টি বা বিনাশ কৰিব নোৱাৰি ।
4. ডেল্টনৰ পৰমাণুবাদৰ কোনটো স্বীকাৰ্য্যই স্থিৰানুপাতত সূত্ৰটো ব্যাখ্যা কৰিব পাৰে?
উত্তৰঃ ৰাসায়নিক বিক্ৰিয়াত পৰমাণুবোৰ সৰল গোটা সংখ্যাৰ অনুপাতত যোজিত হয় ।
প্রশ্নাৱলী
1. পাৰমাণৱিক ভৰ এককৰ সংজ্ঞা দিয়া।
উত্তৰঃ পাৰমাণবিক ভৰ একক হৈছে এটা 12c পৰমাণুৰ ভৰৰ 1/2 ভাগ ।
2. খালী চকুৰে পৰমাণু এটা দেখা সম্ভব নহয় কিয় ?
উত্তৰঃ কাৰণ পৰমাণু পদাৰ্থৰ ক্ষুদ্রতম কণিকা।
প্রশ্নাৱলী
(i) সংকেত লিখা।
(ii) ছডিয়াম অক্সাইড।
(iii) ছডিয়াম ছালফাইড।
(iv) মেগনেছিয়াম হাইড্রক্সাইড।
উত্তৰঃ (i) ছডিয়াম অক্সাইডৰ সংকেত

সংকেত = Na₂O
(ii) এলুমিনিয়াম ক্লৰাইডঃ

সংকেত = AICL₂
(iii) ছডিয়াম ছালফাইড:

সংকেত = Na₂S
(iv) মেগনেছিয়াম হাইড্রক্সাইডঃ চিহ্নঃ

সংকেত = Mg (OH)₂
2. তলৰ সংকেতবোৰে বুজোৱা যৌগবোৰৰ নাম লিখাঃ
(i) ALL (SO₄)₂
উত্তৰঃ এলুমিনিয়াম ছালফেট।
(ii) CaCl₂
উত্তৰঃ কেলছিয়াম ক্লৰাইড।
(iii) KSO₄
উত্তৰঃ পটাছিয়াম ছালফেট।
(iv) KNO₃
উত্তৰঃ পটাছিয়াম নাইট্রেট।
(v) CaCo₃
উত্তৰঃ কেলছিয়াম কার্বনেট।
3. ৰাসায়নিক সংকেত পদটোৰ দ্বাৰা কি বুজোৱা হৈছে?
উত্তৰঃ অনু গঠিত হোৱা বিভিন্ন পৰমাণুবোৰৰ চিহ্ন আৰু সেই পৰমাণুৰ সংখ্যা চিহ্নৰ তলত পদাংক হিচাপে লিখি উপস্থাপন কৰাকে ৰাসায়নিক সংকেত বোলে।
4. (i) H₂S অনু আৰু
(ii) PO₄⁻³আয়নত কেইটাকৈ পৰমাণু আছে?
উত্তৰঃ(i) H₂S অণুত দুটা হাইড্ৰজেন(H) পৰমাণু আৰু এটা ছালফাৰ (S) পৰমাণু থাকে।
(ii) PO₄⁻³আয়ণত এটা ফছফৰাছ (P) পৰমাণু আৰু তিনিটা অক্সিজেন (O) পৰমাণু থাকে।
প্রশ্নাৱলী
1. H₂, O₂, Cl₂, CO₂, CH₄, C₂H₆⁻, C₂H₄, NH₃আৰু CH3OHৰ আণবিক ভৰ গণনা কৰা।
উত্তৰঃ H ৰ আণবিক ভৰ = 2 × 1 = 2u
O₂ ৰ আণবিক ভৰ = 2 × 16 = 32u
Cl₂ ৰ আণবিক ভৰ = 2 × 35.5 =7lu
CH₄ ৰ আণবিক ভৰ = 12 + 4 x 1 = 16u
CO₂ ৰ আণবিক ভৰ = 12+2 × 16 = 12 +32=44u
C₂H₄ আণবিক ভৰ = 2 x 12 + 6 × 1 = 24 + 6 =30u
C₂H₄ ৰ আণবিক ভৰ = 2 x 12 + 4 × 1 = 24 + 4 = 28u
NH₃ ৰ আণবিক ভৰ = 14+ 3×1 = 14+ 3 = 17u
CH₃OH ৰ আণবিক ভৰ = 12 + 3 × 1 + 16×1 = 12+3+17 = 32u
2. ZnO, Na₂O আৰু K₂CO₃ৰ সংকেত গোট ভৰ গণনা কৰা। প্রদত্ত পাৰমাণৱিক ভৰবোৰ হ’ল Zn = 64u, Na = 23u, K = 39u,C=12u আৰু 0 = 16u
উত্তৰঃ ZnOৰ সংকেত গোট ভৰ = 65u+ 16u
= 81u
Na₂0 ৰ সংকেত গোট ভৰ = 2 × 23u + 16u
= 46u + 16u
= 62u
K₂CO₃ ৰ সংকেত গোট ভৰ = 2 x 39u + 12u + 3x 16u
= 78u+12u+ 48u
= 138u
প্রশ্নাৱলী
1. এক ম’ল কাৰ্বন পৰমাণুৰ ভৰ 12 গ্রাম হ’লে 1টা কাৰ্বন পৰমাণুৰ ভৰ (গ্ৰামত) কিমান হ’ব?
উত্তৰঃ 1 ম’ল কাৰ্বন পৰমাণু = 6.023× 10²³টা পৰমাণু
এতিয়া,
6.023×10²³টা কার্বন পৰমাণুৰ ভৰ = 12 গ্রাম
∴ 1 টা কার্বন পৰমাণুৰ ভৰ = 12/6.023×10²³গ্রাম
= 1.99×10⁻²³ গ্রাম
2. 100 গ্রাম ছডিয়াম বা 100 গ্রাম আইৰণৰ কোনটোত পৰমাণুৰ সংখ্যা বেছি থাকিব। (দিয়া আছে Naৰ পাৰমাণৱিক ভৰ = 23u, Fe= 56u) ?
উত্তৰঃ ছডিয়ামৰ পাৰমাণবিক ভৰ = 23u
1 ম’ল ছডিয়ামৰ ভৰ = 23 গ্রাম
23 গ্রাম ছডিয়ামত থকা পৰমাণুৰ সংখ্যা
=6.023×10²³টা
∴ 1 গ্রাম ছডিয়ামত থকা পৰমাণুৰ সংখ্যা
= 6.023/23×10²³
∴ 100 গ্রাম ছডিয়ামত থকা পৰমাণুৰ সংখ্যা
= 6.023×10²³×100 টা
= 0.261 × 10²⁵টা
= 2.61 × 10²⁴ টা
আইৰণৰ পাৰমাণবিক ভৰ = 56u
∴ 1 ম’ল আইৰণৰ ভৰ = 56 গ্রাম
56 গ্রাম আইৰণত থকা পৰমাণুৰ সংখ্যা = 6.023× 10²³ টা
∴ 1 গ্রাম আইৰণত থকা পৰমাণুৰ সংখ্যা
= 6.023/56×10²³ টা
∴ 100 গ্রাম আইৰণত থকা পৰমাণুৰ সংখ্যা
= 6.023/56× 10²³× 100 টা
= 0.107 × 102²⁵টা
= 1.07 × 10²⁴ টা
এতেকে 100 গ্রাম ছডিয়ামৰ পৰমাণুৰ সংখ্যা বেছি থাকিব।
অনুশীলনী
1. অক্সিজেন আৰু ৰ’ৰণেৰে গঠিত যৌগৰ নমুনা এটাৰ 0.24gm বিশ্লেষণ কৰাত 0.096 gm বৰণ আৰু 0.144 gm অক্সিজেন পোৱা গৈছিল। ভৰ হিচাপত যৌগটোৰ শতকৰা সংযুতি গণনা কৰা।
উত্তৰঃ যৌগটোৰ ভৰ = 0.24 gm
বৰণৰ ভৰ = 0.096gm
অক্সিজেনৰ ভৰ = 0.144gm
বৰণৰ শতকৰা পৰিমাণ = 0.096/0.24 ×100
= 96/240×100
= 40
অক্সিজেনৰ শতকৰা পৰিমাণ = 0.144 /0.24×100
= 144/240×100
= 60
2. 3.0gm কার্বন 8.00gm অক্সিজেনৰে সৈতে দহন কৰাত 11.00gm কার্বন ডাই অক্সাইড উৎপন্ন হ’ল। 3.00gm কার্বন 50.00 gm অক্সিজেন দহন কৰিলে গঠন হোৱা কাৰ্বন ডাই অক্সাইডৰ ভৰ কিমান হ’ব? ৰাসায়নিক সংযোগত কোনটো বিধি তোমাৰ উত্তৰৰ ক্ষেত্ৰত প্রযোজ্য হ’ব?
উত্তৰঃ 3.0 gm কাৰ্বন 8.00gm অক্সিজেনৰ সৈতে দহন কৰাত 11.00 gm কার্বন ডাই অক্সাইড উৎপন্ন হ’ল ।
C + O₂ → CO
স্থিৰানুপাত বিধি অনুসৰি কাৰ্বন ডাই অক্সাইডত সদায় কাৰ্বন আৰু অক্সিজেনৰ ভৰৰ অনুপাত 3 : 8। গতিকে 3.00gm কার্বন 50.00gm অক্সিজেনত দহন কৰিলেও গঠন হোৱা কার্বন ডাই অক্সাইডৰ ভৰ 11.00gm হ’ব।
ইয়াত ৰাসায়নিক সংযোগৰ স্থিবানুপাত বিধি প্রযোজ্য হয়।
3.বহুপাৰমাণৱিক আয়নবোৰ কি ? উদাহৰণ দিয়া।
উত্তৰঃ একাধিক পৰমাণুৰ আধানযুক্ত গোট একোটাক বহুপাৰমাণৱিক আয়ন বোলা হয়।
উদাহৰণ — SO₄², SO₃²⁻, NH₄⁺ ‘ইত্যাদি।
4.তলত দিয়াবোৰৰ ৰাসায়নিক সংকেত লিখা।
(a) মেগনেছিয়াম ক্লৰাইড।
(b) কেলছিয়াম অক্সাইড।
(c) কপাৰ নাইট্রেট।
(d) এলুমিনিয়াম ক্লাইড।
(e) কেলছিয়াম কার্বনেট।
উত্তৰঃ (a) মেগনেছিয়াম ক্লৰাইডৰ সংকেতঃ

সংকেত = MgCl₂
(b) কেলছিয়াম অক্সাইডৰ সংকেতঃ
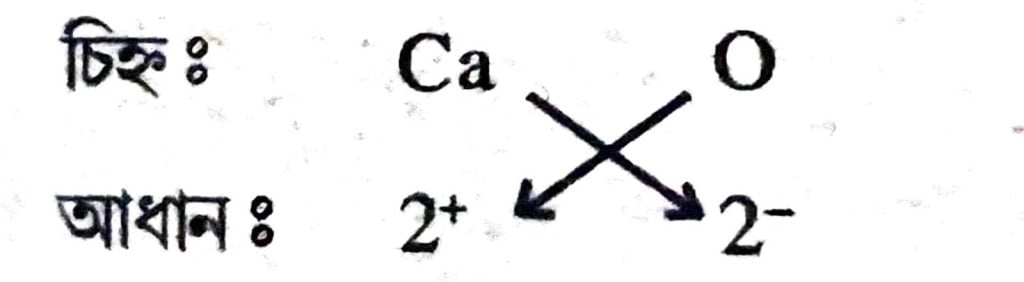
সংকেত = Ca²O²বা CaO
(c) কপাৰ নাইট্রেটৰ সংকেতঃ

সংকেত = Cu(NO₃)²
(d) এলুমিনিয়াম ক্লৰাইডৰ সংকেতঃ Al CI

সংকেত = • AICI₃
(e) কেলচিয়াম কার্বনেটৰ সংকেত :
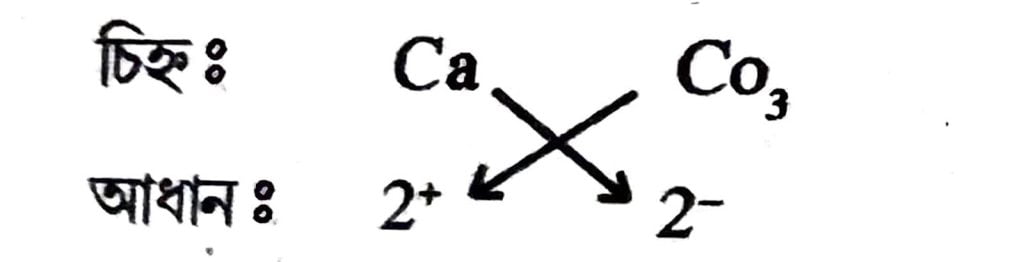
সংকেত = Ca₂(CO₂)₂ বা CaCO₃
5. তলৰ যৌগবোৰত থকা মৌলবোৰৰ নাম দিয়াঃ
(a) পোৰা চূণ(Quick Lime)
উত্তৰঃ পোৰা চূণ (CaO) :- কেলছিয়াম, অক্সিজেন
(b) হাইড্ৰজেন ব্র’মাইড
উত্তৰঃ হাইড্ৰজেন ব্র’মাইড (HBr) :- হাইড্রজেন, ব্রমিন
(c) বেকিং পাউডাৰ
উত্তৰঃ বেকিং পাউডাৰ (NaH CO₃):- ছডিয়াম, হাইড্রজেন, কার্বন,অক্সিজেন
(d) পটেছিয়াম ছালফেট
উত্তৰঃ পটেছিয়াম ছালফেট (K₂SO₄ ) :- পটেছিয়াম, ছালফাৰ,অক্সিজেন
6. তলৰ পদাৰ্থবোৰৰ ম’লাৰ ভৰ গণনা কৰা।
(a) ইথাইন C₂H₂
(b) ছালফাৰ অণু, S₈
(c) ফছফৰাছ অণু, P₄ (ফছফৰাছৰ পাৰমাণবিক ভৰ = 31 )
(d) হাইড্রক্লৰিক এছিড, Hcl
(e) নাইট্রিক এছিড, HNO₃
উত্তৰঃ (a) ইথাইনৰ (C₂H₂ ম’লাৰ ভৰ =(2×12+2×1) gm
= (24 + 2) gm
= 26 gm
(b) ছালফাৰ অণু (S₈)ৰ ম’লাৰ ভৰ = 8 × 32gm
= 256gm
(c) ফছফৰাছ অণু (P)ৰ ম’লাৰ ভৰ = 4 × 31gm
= 124gm
(d) হাইড্রক্লৰিক এছিড (Hel)ৰ ম’লাৰ ভৰ = 1+35.5gm
= 36.5gm
(e) নাইট্রিক এছিড (HNO₃)ৰ ম’লাৰ ভৰ = (1 +14+3×16) gm
= (15 + 48) gm
= 63 gm
7. ভৰ কিমান
(a) 1 ম’ল নাইট্ৰ’জেন পৰমাণুৰ?
(b) 4 ম’ল এলুমিনিয়াম পৰমাণু (এলুমিনিয়ামৰ পাৰমাণবিক ভৰ= 27) ৰ?
(c) 10 ম’ল ছডিয়াম ছালফাইট (Na₂SO₃) ৰ?
উত্তৰঃ (a) 1 ম’ল নাইট্ৰ’জেন পৰমাণু = 14 gm
(b) 1 ম’ল এলুমিনিয়াম পৰমাণু = 27 gm
∴ 4 ম’ল এলুমিনিয়াম পৰমাণু = 27 × 4gm
= 108gm
(c)1 ম’ল ছডিয়াম ছালফাইট = (2×23 + 32 + 3×16)gm
= (46+ 32+48)gm
= 126gm
∴ 10 ম’ল ছডিয়াম ছালফাইট = 126 ×10gm
= 1260gm
8. ম’ললৈ পৰিবৰ্তন কৰা :
(a) 12gm অক্সিজেন গেছ।
(b) 20gm পানী।
(c) 22 gm কার্বন-ডাই-অক্সাইড।
উত্তৰঃ (a) অক্সিজেনৰ (O₂) আণৱিক ভৰ = 32 gm
এতিয়া,
32gm অক্সিজেন গেছ = 1 ম’ল
∴ 1gm অক্সিজেন গেছ = 1/32 ম’ল
∴ 12 অক্সিজেন গেছ = 1/32×12 ম’ল
= 0.375 ম’ল
(b) পানী (H₂O)ৰ আণবিক ভৰ = 18 গ্রাম
18 গ্রাম পানী = 1 ম’ল
∴ 1 গ্রাম পানী = 1/18 ম’ল
∴ 20 গ্রাম পানী = 20/18 ম’ল
= 1.11 ম’ল
(c) কার্বন-ডাই-অক্সাইড (CO₂)ৰ আণবিক ভৰ = 44 গ্রাম
44 গ্রাম কার্বন-ডাই-অক্সাইড = 1 ম’ল
∴ 1 গ্রাম কার্বন-ডাই-অক্সাইড = 1/44 ম’ল
∴ 22গ্রাম কার্বন-ডাই-অক্সাইড = 22/44 ম’ল
= 0.5
9. ভৰ কিমান?
(a) 0.2 ম’ল অক্সিজেন পৰমাণুৰ?
(b) 0.5 ম’ল পানী অণুৰ?
উত্তৰঃ 1 ম’ল অক্সিজেন পৰমাণুৰ ভৰ = 16 গ্রাম
∴ 0.2 ম’ল অক্সিজেন পৰমাণুৰ ভৰ = 0.2×16গ্রাম
= 3.2 গ্রাম
(b) 1 ম’ল পানী (H₂O) অনুৰ ভৰ = 18 গ্রাম
∴ 0.5 ম’ল পানী (H₂O) অনুৰ ভৰ = 0.5×18 গ্রাম
= 9 গ্রাম
10. 16 gm গোটা ছালফাৰত থকা ছালফাৰ অণু (S₈)ৰ সংখ্যা গণনা কৰা।
উত্তৰঃ গোটা ছালফাৰৰ ভৰ = 16gm
1 ম’ল ছালফাৰৰ (S₈) ভৰ = 8 ×32gm
= 256gm
∴ 16 gm ছালফাৰত থকা ছালফাৰ অণুৰ
সংখ্যা =16/256×8×6.023×10²³
= 3.011 × 10²³
11. 0.051gm এলুমিনিয়াম অক্সাইডত থকা এলুমিনিয়াম আয়নৰ সংখ্যা গণনা কৰা ।
উত্তৰঃ এলুমিনিয়াম আয়ণৰ (Al₃⁺) 1 মল = 27gm
এলুমিনিয়াম আয়ণৰ 27gm = 1 ম’ল
∴ এলুমিনিয়াম আয়ণৰ 0.051gm =0.051/27 ম’ল
1 ম’ল এলুমিনিয়াম অক্সাইডত থকা আয়ণৰ সংখ্যা
∴ 0.057/27 ম’ল এলুমিনিয়াম অক্সাইডত থকা আয়ণৰ সংখ্যা = 0.051/27×6.023×10²³ = 51/27×6.023×10²⁰
= 1.889 x 6.023×10²⁰
= 11.78 x 10²⁰
= 1.178 × 10²¹টা
অতিৰিক্ত প্রশ্ন উত্তৰঃ
চুটি উত্তৰৰ প্ৰশ্নঃ
1. পৰমাণু বুলিলে কি বুজা ?
উত্তৰঃ মৌলৰ স্বাধীনভাৱে বৰ্তি থাকিব পৰা আৰু তাৰ সকলোবোৰ ৰাসায়নিক ধৰ্ম ধৰি ৰাখিব পৰা ক্ষুদ্রতম কণা এটাই পৰমাণু।
2. স্থিৰানুপাত বিধিৰ মূল তত্ব কি?
উত্তৰঃ এটা ৰাসায়নিক যৌগত মৌলসমূহ সদায়েই নিৰ্দিষ্ট ভৰৰ অনুপাতত থাকে ।
3. হাইড্ৰজেন পৰমাণু এটাৰ ব্যাসার্ধ কিমান?
উত্তৰঃ 10⁻¹⁰ m
4. IUPACৰ সম্পূর্ণ অর্থ কি?
উত্তৰ: International Union of Pure and Applied chemistry.
5. ভৰৰ নিত্যতা বিধিটো কি?
উত্তৰঃ ৰাসায়নিক বিক্রিয়া এটাত বিক্রিয়ক আৰু বিক্রিয়াজাত পদাৰ্থৰ ভৰসমূহৰ যোগফল অপৰিবৰ্তিত হৈ থাকে।
6. এটা দ্বি-পাৰমাণৱিক অণুৰ নাম লিখা।
উত্তৰঃ অক্সিজেন (O₂)
7. দুটা এক পাৰমাণবিক মৌলৰ নাম লিখা।
উত্তৰঃ আৰ্গন আৰু হিলিয়াম।
8. এটা ত্ৰিপাৰমাণৱিক গেছৰ নাম লিখা।
উত্তৰঃ হাইড্ৰজেন ছালফাইড, (H₂S)
9. আপেক্ষিক পাৰমাণবিক ভৰ বুলিলে কি বুজা?
উত্তৰঃ কোনো মৌলৰ আপেক্ষিক পাৰমাণৱিক ভৰ হৈছে এনে এটা সংখ্যা যিটো সংখ্যাই মৌলটোৰ এটা পৰমাণু 12c সমস্থানিকৰ এটা পৰমাণুৰ 1/12ভাগতকৈ কিমান গুণ গধুৰ তাকে বুজায়।
উদাহৰণ স্বৰূপে অক্সিজেনৰ এটা পৰমাণু 12c সমস্থানিকৰ এটা পৰমাণুৰ 1/12 ভাগতকৈ 16 গুণে গধুৰ। গতিকে অক্সিজেনৰ আপেক্ষিক পাৰমাণবিক ভৰ হ’ব 16u ।
10. অণু বুলিলে কি বুজা?
উত্তৰঃ কোনো মৌল বা যৌগৰ সাধাৰণ অৱস্থাত স্বাধীন স্থিতি থকা আৰু সেই পদাৰ্থৰ আটাইবোৰ ধৰ্ম নিহিত থকা ক্ষুদ্রতম কণিকাটোৱেই হৈছে অণু।
11. আপেক্ষিক আণবিক ভৰ কাক বোলে?
উত্তৰঃ আপেক্ষিক আণবিক ভৰ হৈছে এনে এটা সংখ্যা যিটো সংখ্যাই কোনো এটা অণু 12c সমস্থানিকৰ এটা পৰমাণুৰ 1/12ভাগতকৈ কিমান গুণ গধুৰ তাক বুজায়।
12. গ্রাম পারমাণবিক ভৰ কাক বোলে? উদাহৰণ দিয়া।
উত্তৰঃ পাৰমাণবিক ভৰক গ্ৰামত প্ৰকাশ কৰিলে তাক গ্রাম পাৰমাণবিক ভৰ বোলে। উদাহৰণ স্বৰূপে হাইড্ৰজেনৰ পাৰমাণবিক ভৰ 1u, গতিকে ইয়াৰ প্ৰাম পাৰমাণবিক ভৰ 1 গ্রাম।
13. গ্রাম আণবিক ভৰ কাক বোলে? উদাহৰণ দিয়া।
উত্তৰঃ আণবিক ভৰক গ্ৰামত প্ৰকাশ কৰিলে তাক গ্রাম আণবিক ভৰ বোলে। উদাহৰণ স্বৰূপে H₂, O₂ আৰু H₂Oৰ গ্ৰাম আণবিক ভৰ যথাক্রমে 2 গ্রাম, 32 গ্ৰাম আৰু 18 গ্রাম।
14. গ্রামাণু বুলিলে কি বুজা?
উত্তৰঃ পদাৰ্থ এটাৰ আণবিক ভৰক গ্ৰামত প্ৰকাশ কৰিলে পোৱা সংখ্যাটোক ইয়াৰ গ্রাম আণৱিক ভৰ বা গ্রামাণু বুলি কোৱা হয়। গ্রামাণুক ‘n’ আখৰেৰে বুজোৱা হয়।
n = গ্রাম হিচাপে পদাৰ্থৰ ভৰ / পদাৰ্থৰ গ্ৰাম পাৰমাণবিক ভৰ
15. ৰাসায়নিক সমীকৰণ কি?
উত্তৰঃ ৰাসায়নিক বিক্রিয়া এটা বুজাবলৈ বিক্ৰিয়াত অংশ লোৱা পদাৰ্থবোৰক চিহ্ন আৰু সংকেতৰ দ্বাৰা উপস্থাপন কৰাকে ৰাসায়নিক সমীকৰণ বোলে।
16. যোজ্যতা কাক বোলে?
উত্তৰঃ কোনো মৌলৰ এটা পৰমাণুৰ লগত যোজিত হোৱা হাইড্ৰজেন বা কুৰিণ পৰমাণুৰ সংখ্যাক বা পৰমাণুটোৰ লগত যোজিত হোৱা অক্সিজেন পৰমাণুৰ সংখ্যাৰ দুগুণক সেই মৌলটোৰ যোজ্যতা বুলি কোৱা হয়।
17. পৰিবৰ্তী যোজ্যতা কি? উদাহৰণ দিয়া।
উত্তৰঃ কিছুমান মৌলই যৌগ গঠন কৰোতে এটাতকৈ বেছি যোজ্যতা দেখুৱায়। ইয়াকে পৰিবৰ্তী যোজ্যতা বোলে।
উদাহৰণস্বৰূপে, নাইট্ৰজেনৰ অক্সাইডবোৰত NO₂, NO, N₂O₅, NO₂, আৰু N₂O₅,ত নাইট্ৰজেনৰ যোজ্যতা যথাক্রমে 1, 2, 3, 4 আৰু 5
অৰ্থাৎ নাইট্ৰজেনে পৰিবৰ্তী যোজ্যতা প্ৰদৰ্শন কৰে।
18. কোনবোৰ মৌলই পৰিবৰ্তী যোজ্যতা নেদেখুৱায়?
উত্তৰঃ পৰ্য্যাবৃত্ত তালিকাৰ বৰ্গ 1 আৰু বৰ্গ 2ৰ মৌল সমূহে পৰিবৰ্তী যোজ্যতা নেদেখুৱায়।
19. সম্ভ্রান্ত গেছ সমূহ কি কি?
উত্তৰঃ He, Ne, Ar, Kr, Xe আৰু Rn
20. সম্ভ্ৰান্ত গেছৰ যোজ্যতা কিয় শূণ্য?
উত্তৰঃ কাৰণ ইহঁতে সাধাৰণ অৱস্থাত ৰাসায়নিক বিক্রিয়াত ভাগ নলয়।
21. মূলক কাক বোলে? এটা একযোজী মূলক আৰু এটা দ্বিযোজী মূলকৰ সংকেত লিখা।
উত্তৰঃ কেতিয়াবা বেলেগ বেলেগ মৌলৰ দুটা বা ততোধিক পৰমাণু একেলগে একোটা দুটা বা ততোধিক পৰমানু একেলগে একোটা গোট হৈৰাসায়নিক বিক্ৰিয়াত অংশ গ্ৰহণ কৰে। অৰ্থাৎ এই পৰমাণুৰ গোটবোৰে ৰাসায়নিক বিক্ৰিয়াত এটা পৰমাণুৰ দৰে আচৰণ দেখুৱায়। এই গোটবোৰক মূলক বোলে।
একযোজী মূলক – NH₄
দ্বিযোজী মূলক – CO₃
22. বিক্ৰিয়ক দ্ৰব্য আৰু উৎপন্ন দ্রব্য কাক বোলে? এটা উদাহৰণ দি দেখুওৱা।
উত্তৰঃ বিক্রিয়ক দ্ৰব্য: যিবোৰ পদাৰ্থৰ মাজত বিক্রিয়া ঘটে সেইবোৰক বিক্ৰিয়াক দ্রব্য বোলে।
উৎপন্ন দ্রব্য: বিক্ৰিয়াৰ ফলত উৎপন্ন হোৱা নতুন পদাৰ্থবোৰক উৎপন্ন দ্রব্য বোলে।
উদাহৰণঃ C + O₂ → CO₂
বিক্রিয়ক দ্ৰব্য উৎপন্ন দ্রব্য
23. ম’ল বুলিলে কি বুজা?
উত্তৰঃ 12c সমস্থানিকৰ 0.012 কিল’গ্ৰামত যিমান সংখ্যক কাৰ্বন পৰমাণু থাকে সেই একে সংখ্যক কণিকাত থকা কোনো পদাৰ্থৰ পৰিমাণকে সেই পদাৰ্থটোৰ এক ম’ল বুলি কোৱা হয়।
গাণিতিক প্রশ্ন
1. 12c সমস্থানিক এটা পৰমাণুৰ নিৰপেক্ষ ভৰ গণনা কৰা।
উত্তৰঃ 12c ৰ গ্ৰাম পাৰমাণৱিক ভৰ = 12 গ্রাম
= 6.023×10²³ টা
সমস্থানিক পৰমাণুৰ ভৰ
∴ 12c সমস্থানিকৰ 1 টা পৰমাণুৰ নিৰপেক্ষ ভৰ
= 12/ 6.023×10²³গ্রাম
= 1.993 x10⁻²³ গ্রাম
2. 1 পাৰমাণবিক ভৰ একক (1u)ক SI এককত প্ৰকাশ কৰা।
উত্তৰঃ lu = 1/12×12c সমস্থানিকৰ এটা পৰমাণুৰ ভৰ
= 1/12×1.993×10⁻²³গ্রাম
= 1.66×10⁻²⁴গ্রাম
= 1.66×10⁻²⁷কি.গ্রাম।
3. 10 গ্রাম কেলছিয়ামত কিমান ম’ল পৰমাণু আছে?
উত্তৰঃ কেলছিয়ামৰ পাৰমাণবিক ভৰ = 40 গ্রাম
40 গ্রাম কেলছিয়ামত থকা পৰমাণুৰ সংখ্যা = 1 ম’ল
∴ 1 গ্রাম কেলছিয়ামত থকা পৰমাণুৰ সংখ্যা = 1/40 ম’ল
∴ 10 গ্রাম কেলছিয়ামত থকা পৰমাণুৰ সংখ্যা = 1/40×10 ম’ল
= 1/4 ম’ল
= 0.25 ম’ল পৰমাণু
4. 0.9 গ্রাম এলুমিনিয়ামত কিমানটা পৰমাণু আছে গণনা কৰা।
উত্তৰঃ এলুমিনিয়ামৰ পাৰমাণৱিক ভৰ = 27 গ্রাম
27 গ্রাম এলুমিনিয়ামত থকা পৰমাণুৰ সংখ্যা = 6.023×10²³টা
∴ 1 গ্রাম এলুমিনিয়ামত থকা পৰমাণুৰ সংখ্যা = 6.023×10²³/27 টা
∴ 0.9 গ্রাম এলুমিনিয়ামত থকা পৰমাণুৰ সংখ্যা
= 6.023×10²³/27×0.9
= 0.2007×10²³
= 2.007 × 10²²টা
5. এটা অক্সিজেন অণুৰ নিৰপেক্ষ ভৰ গণনা কৰা।
উত্তৰঃ অক্সিজেন অণু এটাৰ আণবিক ভৰ = 32 গ্রাম
∴ অক্সিজেন অণুৰ নিৰপেক্ষভৰ
= আণবিক ভৰ/6.023×10²³গ্রাম
= 32 / 6.023×10²³গ্রাম
= 5.312 × 10⁻²³ গ্রাম
6. 4.9 গ্রাম ছালফিউৰিক এছিডৰ কিমান ম’ল আছে গণনা কৰা।
উত্তৰঃ ছালফিউৰিক এছিডৰ (H₂SO₄) আনবিক ভৰ
= (2×1+32+4×16) গ্রাম
= (2 + 32+64) গ্রাম
= 98 গ্রাম
98 গ্রাম H₂SO₄ = 1 ম’ল
∴ 1গ্রাম H₂SO₄ = 1/98 ম’ল
∴ 4.9 গ্রাম H₂SO₄ = 1/98× 4.9 ম’ল
= 0.05 ম’ল
7. 10 গ্রাম কেলছিয়াম কার্বনেট (CₐCO₃)ত কিমান অণু আছে গণানা কৰা।
উত্তৰঃ কেলছিয়াম কার্বনেটৰ (CaCo₃) আনবিক ভৰ
= (40 + 12 + 3×16) গ্রাম
= (40 + 12 + 48) গ্রাম
= 100 গ্রাম
100 গ্রাম কেলছিয়াম কার্বনেটত থকা অনুৰ সংখ্যা = 6.023 × 10²³টা
∴ 1 গ্রাম কেলছিয়াম কার্বনেটত থকা অনুৰ সংখ্যা = 6.023×10²³/100
∴ 10 গ্রাম কেলছিয়াম কার্বনেটত থকা অনুৰ সংখ্যা=
6.023×10²³/100×10
= 6.023×10²³/10 টা
= 6.023× 10²²টা
8. তলত দিয়া বিক্রিয়া অনুসতি 3.6 গ্রাম পানী উৎপন্ন হ’বলৈ কিমান গ্রাম ছ’ডিয়াম হাইড্ৰ’ক্সাইড (NaOH)ৰ আৱশ্যক হ’ব?
H₂SO₄+ 2NaOH → Na₂SO₄ + 2H₂O
উত্তৰঃ সমতুল বিক্ৰিয়াটো
H₂SO₄+ 2NaOH → Na₂SO₄ + 2H₂O
2 মল 2 মল
= 2(23 + 16+1) = 2(2×1+16)
= 2 (40) = 2 (2 + 16)
= 80 গ্রাম = 36 গ্রাম
36 গ্রাম পানী উৎপন্ন হ’বলৈ প্ৰয়োজন হোৱা NaOHৰ পৰিমাণ = 80 গ্রাম
∴ গ্রাম পানী উৎপন্ন হ’বলৈ প্ৰয়োজন হোৱা NaOHৰ পৰিমাণ = 80/36 গ্রাম
∴ 3.6 গ্রাম পানী উৎপন্ন হ’বলৈ প্ৰয়োজন হোৱা NaOHৰ পৰিমাণ = 80/36×3.6 = 8 গ্রাম
9. 1 গ্রাম হাইড্ৰ’জেন গেছৰ লগত 40 গ্রাম কৰিণৰ বিক্রিয়া ঘটিবলৈ দিলে কোনটো গেছৰ কিমান অণু বিক্রিয়া নোহোৱাকৈ থাকিব গণনা কৰা।
উত্তৰঃ সমতুল বিক্ৰিয়াটো
H₂ + Cl₂ → 2Hcl
1 ম’ল 1 ম’ল
= 2 ×1 গ্রাম = 2×35.5
= 2 গ্রাম = 71 গ্রাম
2 গ্রাম H₂য়ে বিক্রিয়া কৰে 71 গ্রাম CI₂ৰ লগত
∴ 1 গ্রাম H₂য়ে বিক্রিয়া কৰে 71/2=35.5 গ্রাম Cl₂Oৰ লগত
প্রশ্নমতে CI₂ৰ ভৰ = 40 গ্রাম
∴ বিক্রিটা নোহোৱা CI₂ৰভৰ = (40 – 35.5) গ্রাম = 4.5 গ্রাম
এতিয়া,
71 গ্রাম Cl₂= 6.023 × 10²² টা অণু
∴ 1 গ্রাম Cl₂ = 6.023 × 10²³ / 71 টা অণু
∴ 4.5 গ্রাম Cl₂= 6.023 ×10²³×4.5/71 টা অণু
= 0.381 × 10²³টা অণু
= 3.81 × 10²²টা অণু
∴ নিৰ্ণেয় অণুৰ সংখ্যা = 3.81 × 10²² টা Cl₂অণু
10. 32 গ্রাম অক্সিজেনত কিমান গ্রাম পৰমাণু অক্সিজেন আছে?
উত্তৰঃ অক্সিজেনৰ পাৰমাণবিক ভৰ = 16 গ্রাম
16 গ্রাম অক্সিজেনত থকা গ্রাম পৰমাণুৰ সংখ্যা = 1
∴ গ্রাম অক্সিজেনত থকা গ্রাম পৰমাণুৰ সংখ্যা = 1/16
∴ গ্রাম অক্সিজেনত থকা গ্রাম পৰমাণুৰ সংখ্যা
= 32/16 = 2
11. 22 গ্রাম কার্বন-ডাই-অক্সাইডত থকা গ্রামাণুৰ সংখ্যা গণনা কৰা
উত্তৰঃ কার্বন-ডাই-অক্সাইড (CO₂)ৰ আণবিক
= 12 + 2 ×16
= 12+32
= 44 গ্রাম
44 গ্রাম কার্বন-ডাই-অক্সাইডত থকা গ্রামাণুৰ সংখ্যা =1
∴ 1 গ্রাম কার্বন-ডাই-অক্সাইডত থকা গ্রামাণুৰ সংখ্যা = 1/44
∴ 22 গ্রাম কার্বন-ডাই-অক্সাইডত থকা গ্রামাণুৰ সংখ্যা = 22/44 = 0.5
12. কি.গ্রা. ছালফিউৰিক এছিডত ইয়াৰ কিমান গ্রামাণু আছে?
উত্তৰঃ ছালফিউৰিক এচিড (H₂SO₄)ৰ আণবিক ভৰ
= (2 × 1+ 32 + 4 × 16) গ্রাম
= (2 + 32 + 64) গ্রাম
= 98 গ্রাম
98 গ্রাম H₂SO₄ত থকা গ্রামাণুৰ সংখ্যা = 1
∴ 1 গ্রাম H₂SO₄ ত থকা গ্রামাণুৰ সংখ্যা = 1/98
∴ 1 কি.গ্রা. বা 1000 গ্রাম H₂SO₄ থকা গ্ৰামাণুৰ সংখ্যা = 1000/98
= 10.204
13. তলত দিয়াবোৰৰ ভৰ গণনা কৰা –
(a) ম’ল Nacl
(b) 3.011× 10²⁴ অণু HN₃
উত্তৰঃ (a) Naclৰ আণবিক ভৰ
= (23+35.5) গ্রাম
= 58.5 গ্রাম
1 ম’ল Nacl = 58.5 গ্রাম
∴ 5 ম’ল Nacl = 5 × 58.5 গ্রাম
= 292.5 গ্রাম
(b) NH₃ৰ আণবিক ভৰ = (14+ 3×1) গ্রাম
= 17 গ্রাম
6.023×10²³ টা NH₃ অণু = 17 গ্রাম
∴ 1 টা NH₃ অণু = 17/6.023×10²³ গ্রাম
∴ 3.01 × 10²⁴ টা NH₃ অণু
= 17×3.011×10²⁴/ 6.023×10²³ গ্রাম
= 8.498 × 10 গ্রাম
= 84.98 গ্রাম
= 85 গ্রাম
14. তলত দিয়া বিক্রিয়া অনুসৰি গণনা কৰা –
2NaOH + H₂SO₄ → Na₂SO₄+ 2H₂O
(a) 20 গ্রাম NaOHৰ সৈতে বিক্রিয়া কৰা H₂SO₄ ৰ ভৰ।
(b) 2 ম’ল H₂SO₄ ৰ পৰা উৎপন্ন হোৱা Na₂SO₄ ৰ ম’ল সংখ্যা।
উত্তৰঃ (a) সমতুল্য সমীকৰণটো
2NaOH + H₂SO₄ → Na₂SO₄ + 2H₂O
2 ম’ল 1 ম’ল
= 2 (23 + 16 + 1) = (2×1 + 32+4×16)
= 2 x 40 গ্রাম = (2 + 32 + 64) গ্রাম
= 80 গ্রাম = 98 গ্রাম
এতিয়া,
80 গ্রাম NaOHৰ সৈতে বিক্রিয়া কৰা H₂SO₄ৰ ভৰ = 98 গ্রাম
∴ 1গ্রাম NaOHৰ সৈতে বিক্রিয়া কৰা H₂SO₄ৰ ৰ ভৰ = 98/80
∴ 20 1গ্রাম NaOHৰ সৈতে বিক্রিয়া কৰাH₂SO₄ৰ ভৰ = 98×20/80
= 24.5 গ্রাম
(b) 1 ম’ল H₂SO₄ ৰ পৰা উৎপন্ন হোৱা H₂SO₄ৰ ৰ ম’ল সংখ্যা = 1
∴ 2 ম’ল H₂SO₄ ৰ পৰা উৎপন্ন হোৱা H₂SO₄ৰ ৰ ম’ল সংখ্যা = 2
15. 1.8 গ্রাম পানীত থকা পানীৰ অণু গণনা কৰা।
উত্তৰঃ পানীৰ (H₂O) আণবিক ভৰ = (2 × 1 + 16) গ্রাম
18 গ্রাম পানীত থকা পানীৰ অণু = 6.023×10 টা
∴ 1 গ্রাম পানীত থকা পানীৰ অণু = 6.023×10²³/18 টা
∴ 1.8 গ্রাম পানীত থকা পানীৰ অণু
= 6.023×10²³×1.8 / 18টা
= 6.023×102² ³× 0.1
= 6.023 × 10²² টা
16. তলত দিয়া প্ৰতিটো প্ৰশ্নৰ চাৰিটাকৈ উত্তৰ দিয়া আছে। শুদ্ধ উত্তৰটো বাছি উলিওৱা।
(a) 1 পাৰমাণৱিক ভৰ একক, 1u হৈছে
(i) 1Hৰ টো পৰমাণুৰ ভৰ।
(ii) 12c ৰ এটা পৰমাণুৰ ভৰ।
(iii) 1/12x 12c এটা পৰমাণুৰ ভৰ।
(iv) 1/16×16c ৰ এটা পৰমাণুৰ ভৰ।
উত্তৰঃ (iii) 1/12 × 12c ৰ এটা পৰমাণুৰ ভৰ।
(b) ছ’ডিয়ামৰ পাৰমাণৱিক ভৰ 23u। 46 গ্রাম ছডিয়ামত থকা ইয়াৰ ম’ল সংখ্যা হৈছে –
(i) 23
(ii) 46
(iii) 1
(iv) 2
উত্তৰঃ (iv) 2
(c) 0.5 মল Hক 1.5 ম’ল CI₂ৰ সৈতে বিক্ৰিয়া কৰিবলৈ দিলে কিমান ম’ল HCl গেছ উৎপন্ন হ’ব?
(i) 0.5 ম’ল
(ii) 1.5 ম’ল
(iii) 1.0 ম’ল
(iv) 2.0 ম’ল
উত্তৰঃ (iii) 1.0 ম’ল
(d) ফেৰিক অক্সাইডৰ সংকেত হৈছে –
(i) FeO
(ii) FeO₂
(iii) Fe₂O₃
(iv) Fe₃O₄
উত্তৰঃ (iii) (iii) Fe₂O₃
(e) এলুমিনিয়াম অক্সাইডত এলুমিনিয়ামৰ যোজ্যতা হৈছে—
(i) 2
(ii) 3
(iii) 4
(iv) 6
উত্তৰঃ (ii) 3
(f) তলত দিয়াবোৰৰ কোনটোৰ ভৰ আটাইতকৈ বেছি?
(i) 1 গ্রাম পৰমাণু 12c
ii) 0.25 ম’ল CO₂
(iii) 3.011 × 10²⁴ অণু H₂
(iv) 4°C মি.লি. পানী।
উত্তৰ: (iv) 4°Cত। মি.লি. পানী।
17. খালী ঠাই পূৰ কৰা :
(a) 12c পৰমাণুৰ মানক এক পাৰমাণৱিক ভৰ একক বুলি কোৱা হয় আৰু ইয়াৰ চিহ্ন ———- ।
উত্তৰঃ 1/2,u
(b) হাইড্ৰজেনৰ পাৰমাণৱিক ভৰ ——-আৰু গ্ৰাম পাৰমাণৱিক ভৰ ———– ।
উত্তৰঃ 1u, 1 গ্রাম।
(c) এক ম’ল ইথাইন, C₂H₂ত থকা কাৰ্বনৰ ম’ল সংখ্যা ——– আৰু হাইড্ৰজেনৰ পৰমাণুৰ সংখ্যা —— ।
উত্তৰঃ 2,2
(d) চূণ পানী আৰু যিংক ফছফেটৰ সংকেত যথাক্রমে ——– আৰু ——– ।
উত্তৰঃ Ca(OH)₂, Zn₃ (PO₄)₂
(e) সম্ভ্ৰান্ত গেছবোৰৰ যোজ্যতা হৈছে ——–।
উত্তৰঃ 0
18. ডেল্টনৰ পৰমাণু বাদৰ স্বীকাৰ্য্যসমূহ উল্লেখ কৰা।
উত্তৰঃ ডেল্টনৰ পৰমাণুবাদৰ স্বীকাৰ্য্য সমূহঃ—
(i) সকলো পদাৰ্থ পৰমাণু নামৰ অতি ক্ষুদ্র কণাৰে গঠিত।
(ii) পৰমাণুবোৰ অবিভাজ্য কণা যাক ৰাসায়নিক বিক্রিয়া এটাত সৃষ্টি বা বিনাশ কৰিব নোৱাৰি।
(iii) বেলেগ বেলেগ মৌলৰ পৰমাণুবোৰৰ ভৰ আৰু ৰাসায়নিক ধর্মসমূহ বেলেগ বেলেগ ।
(iv) যৌগ গণিব বাবে পৰমাণুবোৰ অখণ্ড সংখ্যাৰ সৰল অনুপাতত যোজিত হয় ।
(v) নিৰ্দিষ্ট যৌগ এটাত পৰমাণুবোৰৰ আপেক্ষিক সংখ্যা আৰু প্ৰকাৰ স্থিৰ থাকে।
19. এভ’গেড্ৰ’ৰ সংখ্যাৰ মান কিমান? ইয়াৰ চিহ্ন কি?
উ্ত্তৰঃ 6.023×10²³প্রতি ম’ল। ইয়াৰ চিহ্ন হৈছে
NA
20. তলত দিয়া যৌগবোৰৰ সংকেত লিখা কিউগ্রিক নাইট্রেট, ছডিয়াম ফছফেট, এলুমিনিয়াম ছালফেট, করাল্ট কার্বনেট, এলুমিনিয়াম অক্সাইড, ফিউপাছক্লৰাইড, বৰিক এছিড, যিংফেট, ফছফৰাছ পেন্ট ‘ক্সাইড, পটেছিয়াম ডাই ক্রমেট, মেগনেছিয়াম ‘মাইড, বেৰিয়াম ফছফেট, ছালফিউৰিক এছিড, নিকেল ছালফেট।
উত্তৰঃ
| যৌগ | সংকেত |
| কিউপ্রিক নাইট্রেট | Cu₂NO₃ |
| ছডিয়াম ফছফেট | Na₃(PO₄)₂ |
| এলুমিনিয়াম ছালফেট | CO₂CO₃ |
| কবাল্ট কার্বনেট | Al₂(SO₄)₂ |
| এলুমিনিয়াম অক্সাইড | Al₂O₃ |
| কিউপ্ৰাছ ক্লৰাইড | Cucl |
| বৰিক এছিড | H₃BO₃ |
| ছডিয়াম যিংকোট | NaZnO₂ |
| ফছফৰাছ পেণ্ট’ক্সাইড | P₂O₅ |
| পটেছিয়াম ডাইক্ৰ’মেট | KCrO₄ |
| মেগনেছিয়াম ব্র’মাইড | Mg₂Br |
| বেৰিয়াম ফছফেট | BaPo₄ |
| ছালফিউৰিক এছিড | H₂SO₄ |
| নিকেল ছালফেট | Ni₂SO₄ |
21. O, O₂ আৰু O₃ৰ প্ৰত্যেকৰে 1 ম’লত থকা পৰমাণুৰ সংখ্যা নির্ণয় কৰা ?
উত্তৰঃ O ৰ 1 ম’ল = 6.023× 10²³ টা পৰমাণু
O₂ ৰ 1 ম’ল = 2 × 6.023× 10²³টা পৰমাণু
= 12.046×10²³ টা পৰমাণু
0₃ ৰ 1 ম’ল = 3 × 6.023× 10²³টা পৰমাণু
= 18.069 × 10²³টা পৰমাণু
22. এটা মৌল X য়ে দুটা যোজ্যতা দেখুৱায় 2 আৰু 4। ইয়াৰ অক্সাইডবোৰৰ সংকেত লিখা।
উত্তৰঃ প্রথম অক্সাইডঃ
| 2 | 2 |
| X | O |
| X₂ | O₂ |
| ৱা X₁ | O₁ |
∴ অক্সাইডৰ সংকেত = XO
দ্বিতীয় অক্সাইড :
| 4 | 2 |
| X | O |
| X₂ | O₄ |
| ৱা X | O₂ |
| ৱা X |
∴ অক্সাইডৰ সংকেত = XO₂
23. এটা মৌল Aৰ আধান 3+। ইয়াত –
(a) ক্লৰাইড।
(b) ছালফেট।
(c) নাইট্রেট।
(d) ফছফেটৰ সংকেত লিখা।
উত্তৰ:

∴ সংকেত = Acl₃

সংকেত = A₂(SO₄)₃

সংকেত = A(NO₃)₃

সংকেত = A₃(PO₃)₃
= APO₄
24. তলত দিয়া যৌগবোৰৰ নাম লিখা।
(i) Al2 (SO₄)₃
(ii) Mg (HCO₃)₂
(iii) (NH₄)₂S
(iv) KMnO₄
(v) KelO₃
(vi) Na₂PbO₂
(vii) KclO
(viii) CuSO₄
(ix) Pb (NO₃)₂
(x) MgCl
(xi) K₂MnO₄
(xii) KclO₄
উত্তৰঃ
| যৌগবোৰৰ সংকেত | নাম |
| (i) Al²(SO₄)₂ | এলুমিনিয়াম ছালফেট |
| (ii) Mg(HCO₃)₂ | মেগনেছিয়াম বাইকার্বনেট |
| (iii) (NH₄)₂S | এমনিয়াম ছালফাইড |
| (iv) KMnO₄ | পটাছিয়াম পাৰমাংগানেট |
| (v) KclO₃ | পটাছিয়াম ক্লৰেট |
| (vi) Na₂PbO₂ | ছডিয়াম প্লামবাইট |
| (vii) KclO | পটাছিয়াম হাইপ ক্লৰাইট |
| (viii) CuSO₄ | কিউপ্রিক ছালফেট |
| (ix) Pb(NO₃)₂ | লেড নাইট্রেট |
| (x) MgCl2 | মেগনেছিয়াম ক্লৰাইড |
| (xi) K₂MnO₄ | পটাছিয়াম মেগাংনেট |
| (xiiii) KclO₄ | পটাছিয়াম পাৰক্লৰেট। |
25. সাধাৰণতে ব্যৱহাৰ হোৱা কেইবিধমান এচিড আৰু ক্ষাৰৰ নাম লিখা।
উত্তৰঃ
| (A) এচিড | নাম |
| HCI | হাইড্ৰ’ক্লৰিক এচিড |
| H₂SO₄ | ছালফিউৰিক এছিড |
| HNO₃ | নাইট্রিক এছিড |
| H₂CO₃ | কার্বনিক এছিড |
| CH₃CooH | এচিটিক এছিড |
| HCOOH | ফমিক এচিড |
| (B) ক্ষাৰ | নাম |
| NaOH | ছডিয়াম হাইড্রক্সাইড |
| KOH | পটাছিয়াম হাইড্রক্সাইড |
| NH₄OH₄ | এমনিয়াম হাইড্রক্সাইড |
| Ca(OH)₂ | কেলছিয়াম হাইড্রক্সাইড |
| Ba(OH)₃ | বেৰিয়াম হাইড্রক্সাইড |
| Al(OH)₃ | এলুমিনিয়াম হাইড্রক্সাইড |
26. শুদ্ধ উত্তৰটো বাছি উলিওৱাঃ
(i) নাইট্ৰজেন গেছৰ ৰাসায়নিক চিহ্ন হ’ল
(a) N⁺
(b) N₂
(c) N
(d) Ni
উত্তৰঃ (b) N₂
(b) ছডিয়ামৰ ৰাসায়নিক চিহ্ন হ’ল—
(a) So
(b) Sd
(c) NA
(d) Na
উত্তৰঃ (d) Na
3. তলৰ কোনটোৰ ওজন বেছি?
(a) 0.2 ম’ল C₁₂ H₂₂ O₁₁
(b) 2 ম’ল CO₂
(c) 2 ম’ল CalO₃
(d) 10 ম’ল H₂O
উত্তৰঃ (c) 2 ম’ল CalO₃
4. তলৰ কোনটোৰ পৰমাণুৰ সংখ্যা বেছি?
(a) 18 গ্রাম CO₂
(b) 18 গ্রাম H₂O
(c) 18 গ্রাম O₂
(d) 18 গ্রাম CH₄
উত্তৰঃ (d) 18 গ্রাম CH₄
5. তলৰ কোনটোৰ আটাইতকৈ বেছি সংখ্যক অণু আছে?
(a) 1 গ্রাম CH₄
(b) 1 গ্রাম CO₂
(c) 1 গ্রাম H₂
(d) 1 গ্রাম N₂
উত্তৰঃ (c) 1 গ্রাম H₂
6. অক্সিজেনৰ 1 টা পৰমাণুৰ ভৰ
(a) 16 / 6.023×10²³ গ্রাম
(b) 8u
(c) 32 / 32 6.023×10²³ গ্রাম
(d) 1 / 6.023×10²³ গ্রাম
উত্তৰঃ (a) 16 6.023×10²³ গ্রাম
7. এক amu ৰ ভৰ
(a) 1.0076 গ্রাম
(b) 1.66 × 10⁻²⁴গ্রাম
(c) 1 গ্রাম
(d) 0.00327 গ্রাম
উত্তৰঃ (b) 1.66 × 10⁻²⁴ গ্রাম
8. এডগেড’ৰ ধ্ৰুৱকৰ মান
(a) 6.022 × 10²⁴
(b) 6.022 × 10²²
(c) 6.022 ×10²³
(d) 6.022 × 10²¹
উত্তৰঃ (c) 6.022 × 10²³
9. স্থিৰানুপাত সূত্ৰটো আগবঢ়াইছিল
(a) John Dalton
(b) Richter
(c) Joseph Proust
(d) Lavoisen
উত্তৰঃ (a) John Dalton.
10. ৰাসায়নিক বিক্ৰিয়াৰ একক –
(a) পৰমাণু
(b) অণু
(c) (a) আৰু (b)
(d) (a) নাইবা (b)
উত্তৰঃ (a) পৰমাণু
11. তলৰ কোনটো এচিড মূলক
(a) Na⁺
(b) K⁺
(c) Mg⁺
(d) Cl⁻
উত্তৰঃ (d) Cl⁻
12. তলৰ কোনটো ক্ষাৰকীয় মূলক – –
(a) CF⁻
(b) So₄ ₂⁻
(c) PO₄⁺³⁻
(d) Na⁺
উত্তৰঃ(d) Na⁺
13. তলৰ কোনটো বহুপাৰমাণবিক আয়ন?
(a) Br⁻
(b) Na⁺
(c) NO³ ⁻
(d) Zn²⁺
উত্তৰঃ (c) NO³ ⁻
14. 1.2 gm কাণত থকা পৰমাণুৰ সংখ্যা :
(a) 6.022 × 10²¹
(b) 6.022 × 10²²
(c) 6.022 × 10²³
(d) 6.022 × 10²⁴
উত্তৰঃ (b) 6.022 x 10²²
15. 2.4gmMg ত থকা ম’লৰ সংখ্যা
(a) 1
(b) 0.1
(c) 0.2
(d) 0.3
উত্তৰঃ (b) 0.1
27. তলত দিয়াবোৰৰ যোজ্যতা কিমান?
(a) SiH₄ত Si ৰ
উত্তৰঃ SiH₄ত siৰ যোজ্যতা = 4
(b) Pcl3 ত P ৰ
উত্তৰঃ Pcl₃ত Pৰ যোজ্যতা = 3
(c) MgO ত Mg ৰ
উত্তৰঃ MgO Mgৰ যোজ্যতা = 2
(d) Cel₄ ত C ৰ
উত্তৰঃ Ccl₄⁺ত Cৰ যোজ্যতা = 4
28. বিভিন্ন যোজ্যতা দেখুওৱা দুটা মৌলৰ নাম লিখা।
উত্তৰঃ আইৰণ (Fe) আৰু টিন (Sn)

Hi, I’m Dev Kirtonia, Founder & CEO of Dev Library. A website that provides all SCERT, NCERT 3 to 12, and BA, B.com, B.Sc, and Computer Science with Post Graduate Notes & Suggestions, Novel, eBooks, Biography, Quotes, Study Materials, and more.



